

 ,Fe元素形成的单质,其晶胞结构为体心立方堆积,如图1中乙所示,Cu元素形成的单质,其晶胞结构为面心立方密堆积,如图1中丙所示.
,Fe元素形成的单质,其晶胞结构为体心立方堆积,如图1中乙所示,Cu元素形成的单质,其晶胞结构为面心立方密堆积,如图1中丙所示. ;乙;丙;
;乙;丙;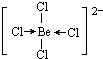 ,
,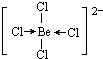 ;
;| 1 |
| 2 |
| 1 |
| 8 |
| 12 |
| NA |
8×
| ||
| a3×10-30cm3 |
| 9.6×1031 |
| a3×NA |
| 9.6×1031 |
| a3×NA |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、一定是金属元素 |
| B、可能是金属元素,也可能不是金属元素 |
| C、一定是ⅠA族元素 |
| D、一定是非主族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol丙烷完全燃烧需4mol氧气 |
| B、与丁烷互为同分异构体 |
| C、能使酸性高锰酸钾溶液褪色 |
| D、分子式为C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
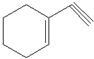 (1)某有机化合物分子结构式如图采取sp2杂化的C原子有
(1)某有机化合物分子结构式如图采取sp2杂化的C原子有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 )发生类似反应①的反应,得到一种环状化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为
)发生类似反应①的反应,得到一种环状化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为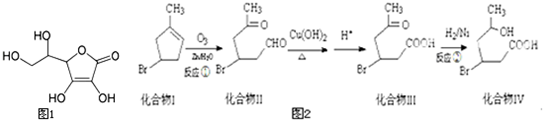
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氨水清洗做过银镜反应的试管 |
| B、向放有电石的圆底烧瓶中,滴入饱和食盐水可产生乙炔气体 |
| C、将2%的NaOH溶液4至5滴,滴入2mL 10%的CuSO4溶液中制得Cu(OH)2悬浊液,加入乙醛溶液加热,用以检验醛基存在 |
| D、已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com