
在一个小烧杯里,加入20g Ba(OH)2•8H2O粉末和10g NH4Cl晶体,将小烧杯放在滴有几滴水的玻璃片上,用玻璃棒快速搅拌.回答问题:
(1)实验中玻璃棒的作用是.
(2)该反应的化学方程式为该反应属于(填反应类型).
(3)实验中观察到现象有玻片与烧杯之间结冰黏在一起;.反应混合物呈糊状,呈糊状的原因是.
(4)通过结冰现象,说明该反应为吸热反应,这是由于反应物的总能量(填“大于”、“小于”或“等于”)生成物的总能量.
考点: 反应热和焓变.
专题: 化学反应中的能量变化.
分析: (1)固体混合物的反应用玻璃棒搅拌有利于充分接触,加速反应进行;
(2)氯化铵和氢氧化钡的反应生成氨气、水、以及氯化钡;铵盐与碱反应为复分解反应;
(3)氯化铵铵盐和强碱氢氧化钡的反应生成氨气、水、以及氯化钡,以此解释反应现象;
(4)玻璃片上结冰而与小烧杯粘在一起,说明氢氧化钡和氯化铵的反应是吸热反应,反应物的总能量小于生成物的总能量.
解答: 解:(1)用玻璃棒迅速搅拌,可以知道玻璃棒的作用是搅拌使混合物充分接触并反应;
故答案为:搅拌使混合物充分接触并反应;
(2)氯化铵属于铵盐,能和强碱氢氧化钡反应生成氨气、水、以及氯化钡,方程式为:Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;
故答案为:Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;复分解反应;
(3)氯化铵铵盐和强碱氢氧化钡的反应是吸热反应,温度降低能让水结冰,导致烧杯和玻璃片粘在一起,同时生成的氨气具有刺激性气味,反应混合物成糊状,原因是反应过程中生成水的缘故,
故答案为:玻片与烧杯之间结冰黏在一起;有少许刺激性气味的气体;反应过程中有水生成;
(4)玻璃片上结冰而与小烧杯粘在一起,说明氢氧化钡和氯化铵的反应是吸热反应,即反应物的总能量小于生成物的总能量.
故答案为:结冰;吸;小于.
点评: 本题考查铵盐与碱的反应,题目难度不大,注意把握氯化铵和氢氧化钡反应的原理及反应现象,注意从反应物与生成物总能量的关系分析.


科目:高中化学 来源: 题型:
在2A(g)+B(g)⇌3C(g)+4D(g)中,表示该反应速率最快的是( )
|
| A. | υA=0.5mol•L﹣1•min﹣1 | B. | υB=0.3mol•L﹣1•min﹣1 |
|
| C. | υC=0.8mol•L﹣1•min﹣1 | D. | υD=1mol•L﹣1•min﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质性质的叙述中,正确的是( )
A.Cl2能与金属活动顺序表中大多数金属反应
B.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
C.硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性
D.硅是应用广泛的半导体材料,常温下化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
从固体混合物A出发可以发生如下框图所示的一系列变化。
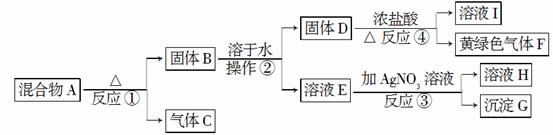
G为不溶于稀硝酸的白色固体;溶液H的焰色反应呈紫色(透过蓝色的钴玻璃观察)。回答下列问题:
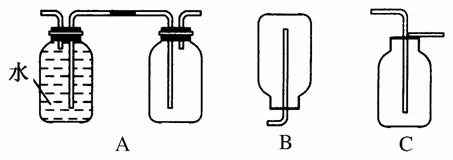
(1)在实验室中收集气体C,可选择如图装置中的________。
(2)操作②的名称是________。在操作②中所使用的玻璃仪器的名称是________。在得到固体D时必须进行洗涤、干燥等操作,洗涤固体D的目的是________________________________________。
(3)写出反应①的化学方程式、反应④的离子方程式:
反应①:_____________________________________________,
反应④:___________________________________________。
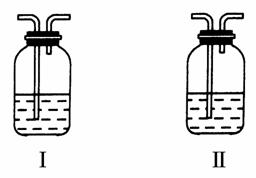
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它依次通过如图中的Ⅰ、Ⅱ装置,其中瓶Ⅰ中盛放的是________,瓶Ⅱ中盛放的是________。
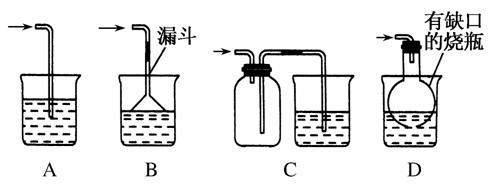
(5)实验中必须吸收多余的气体F,以免污染空气。下图是实验室用NaOH溶液吸收气体F的装置,为防止产生倒吸现象,合理的装置是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是()
X Y
Z W
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是()
A. 氯化钙的电子式: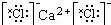
B. 168O2﹣离子的结构示意图: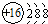
C. H2CO3的电离方程式:H2CO3⇌2H++CO32﹣
D. 葡萄糖的结构简式:C6H12O6
查看答案和解析>>
科目:高中化学 来源: 题型:
下列应用套管实验装置(部分装置未画出)进行的实验,叙述错误的是()
A. 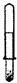
利用此装置可以制取少量H2
B. 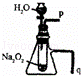
利用此装置可以验证Na2O2与水反应既生成氧气,又放出热量
C. 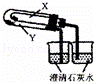
利用此装置验证KHCO3和K2CO3的热稳定性,X中应放的物质是K2CO3
D. 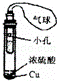
利用此装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用.
(1)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体.
①写出该反应的离子方程式:.
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:;为抑制肼的分解,可采取的合理措施有(任写一种).
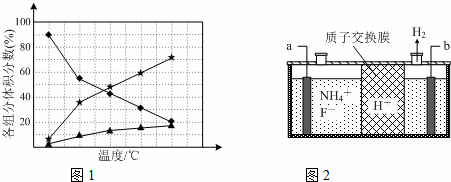
(2)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示.
①氮化硅的化学式为
②a电极为电解池的阳(填“阴”或“阳”)极,写出该电极的电极反应式:电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是F2.
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下合成乙烯。
6H2(g)+2CO2(g)  C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
 (1)乙烯是___________分子。(填极性或非极性)
(1)乙烯是___________分子。(填极性或非极性)
(2)请在方程式上标出该反应电子转移的方向和数目。
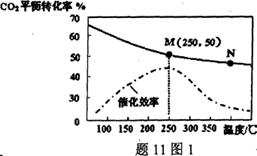
(3)温度对CO2的平衡转化率和催化剂催化效率的影
响如题11图1,下列说法正确的是___________。
A.此反应随温度升高,反应速率一定加快
B.平衡常数:KM>KN
C.M点CO2的平衡转化率受温度、催化剂的共同影响
 (4)若投料比n(H2):n(CO2)=3:1,图中M点乙烯的体积分数为___________ (保留两位有效数字)。
(4)若投料比n(H2):n(CO2)=3:1,图中M点乙烯的体积分数为___________ (保留两位有效数字)。
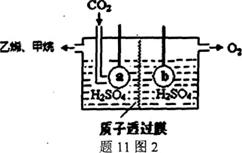
(5)电解法制取乙烯装置如题11图2,电极a接电源的
___________极,生成乙烯的电极反应式为___________。
当左侧有33.6L(标准状况)CO2反应时,左右两侧溶液
质量差|△m右|﹣|△m左|=36g,则乙烯的产率为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com