
| A. | 若混合后溶液pH=7,则c(NH4+)=c(Cl-) | |
| B. | 若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 若混合后溶液满足c(H+)=c(OH-)+c(NH3•H2O),则可推出a=1 |
分析 A、据电荷守恒分析;
B、a=2时,反应后溶液中溶质有氯化铵和盐酸,溶液显酸性;
C、a=0.5时,反应后溶液为相同浓度氯化铵和氨水,溶液显碱性;
D、若氨水与盐酸恰好中和,据电荷守恒和物料守恒可得.
解答 解:A、在氨水与盐酸反应后溶液中,据电荷守恒可知c(H+)+c(NH4+)=c(Cl-)+c(OH-),pH=7,则c(NH4+)=c(Cl-),故A正确;
B、a=2时,反应后溶液中溶质为相同物质的量浓度的氯化铵和盐酸,溶液显酸性,由于NH4+水解,c(NH4+)<c(H+),故B错误;
C、a=0.5时,反应后溶液为相同浓度氯化铵和氨水,溶液显碱性,所以c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C正确;
D、a=1时,氨水与盐酸恰好中和,据电荷守恒有①c(H+)+c(NH4+)=c(Cl-)+c(OH-),据物料守恒有②c(NH3•H2O)+c(NH4+)=c(Cl-),①-②得:c(H+)=c(OH-)+c(NH3•H2O),故D正确;
故选B.
点评 本题考查了电解质溶液中的电荷守恒、盐类水解、溶液中离子浓度大小比较,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | Na2S2O3 | B. | AlCl3 | C. | Na2CO3 | D. | NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应I | 反应II |
| A | 在光照条件下,异丁烷与溴蒸气反应制取(CH3)3CBr | 将乙烯通入溴的四氯化碳溶液中制取1,2一二溴乙烷 |
| B | 在镍作催化剂的条件下,苯与氢气反应生成环乙烷 | 在催化剂作用下,乙烯与水反应生成乙醇 |
| C | 在银作催化剂的条件下,乙醇与空气中的氧气反应生成乙醛 | 在一定条件下,由氯乙烯(CH2=CHCl)合成聚氯乙烯 |
| D | 乙酸乙酯在酸的催化作用下与水反应生成乙酸和乙醇 | 在一定条件下,液态油脂与氢气反应制造人造脂肪 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | n (C)/mol | n(CO2)/mol |
| T1 | 0.15 | |
| T2 | 0.375 |
| A. | 由上述信息可推知:T1>T2 | |
| B. | T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)增大 | |
| C. | T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大 | |
| D. | T1℃时,该反应的平衡常数$K=\frac{9}{16}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
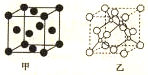 H,C,N,Cr是中学化学常见的几种元素.它们的单质及化和物在生产,生活,科研等方面应用广泛.请回答下列问题:
H,C,N,Cr是中学化学常见的几种元素.它们的单质及化和物在生产,生活,科研等方面应用广泛.请回答下列问题: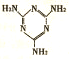
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Ω=2,则有机物
Ω=2,则有机物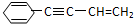 的不饱和度为( )
的不饱和度为( )| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量样品于试管中,滴入稀盐酸,无沉淀,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质 | |
| B. | 取少量样品于试管中,滴入稀硝酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质 | |
| C. | 取少量样品于试管中,滴入稀硫酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质 | |
| D. | 取少量样品于试管中,滴入稀盐酸,若产生使品红溶液褪色的气体,则说明已变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 258Md原子所含中子数与质子数之差为56 | |
| B. | 258Md和260Md互称为同素异形体 | |
| C. | 258Md和260Md为同一种核素 | |
| D. | 有一种Md元素的相对原子质量为258 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY | B. | X2Y3 | C. | XY2 | D. | X2Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com