
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.在SiO2晶体中1mol硅原子形成的Si-O键为2NA
B.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
制备氰氨基化钙的化学方程式为CaCO3+2HCN===CaCN2+CO↑+H2↑+CO2↑,在反应中( )
A.氢元素被氧化,碳元素被还原 B.HCN是氧化剂,不是还原剂
C.CaCN2是氧化产物,H2是还原产物 D.CO是氧化产物,H2是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如下:

(1) Ⅱ中含氧官能团的名称 .
(2) 反应②的化学方程式 。
(3)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式 。
(4) 下列说法正确的是
A. Ⅰ和Ⅴ均属于芳香烃 B. Ⅱ能发生银镜反应
C. Ⅱ能与4molH2发生加成反应 D. 反应③属于酯化反应
(5) A的结构简式 。
(6) Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。写出满足上述条件的Ⅵ的结构简式 。
(7) 一定条件下,化合物Ⅶ( )也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式 。
)也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的溶液混合后,再加足量的稀硝酸,仍有沉淀存在的是( )
A. K2CO3、CaCl2 B. AgNO3、HCl、 C. NaOH、CuSO4 D. Na2CO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32-
B.澄清的溶液中:Na+、K+、MnO4—、AlO2—
C. =10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
=10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
D.c(I-)=0.1 mol·L-1的溶液中:Na+、H+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用铂丝蘸取少量某无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| B | 向浓度均为0.1mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3 溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| D | 向淀粉水解液中加入新制Cu(OH)2,煮沸 | 没有生成砖红色沉淀 | 淀粉未水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g) = MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g) = Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) 的△H3= ▲ 。
(2)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。
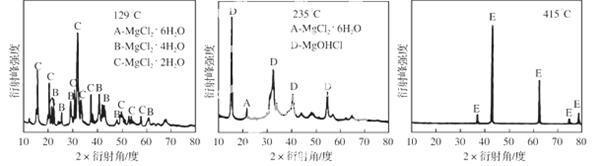
测得E中Mg元素质量分数为60.0%,则E的化学式为 ▲ 。
“一段脱水”的目的是制备MgCl2·2H2O,温度不高于180 ℃的原因是 ▲ 。
 ②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 ▲ 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 ▲ 。
③该工艺中,可以循环使用的物质有 ▲ 。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:
Mg(AlH4)2=MgH2 +2A1+3H2↑
每生成27gAl转移电子的物质的量为 ▲ 。
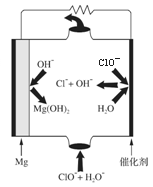
(4)“镁-次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在溶液中能大量共存的是( )。
A. Na+、CO32—、SO42—、H+ B. K+、OH—、H+、Cl—
C. Mg2+、H+、NO3—、SO42— D. Fe3+、K+、OH—、NO3—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com