
某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是:
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同事测得溶液的pH为8.0 | 弱碱性溶液中Mg也可被氧化 |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中OH-氧化了Mg |
科目:高中化学 来源: 题型:
(1)从鸡蛋白的溶液中提取鸡蛋白的方法有________和________。
(2)鸡蛋腐败时会放出有刺激性气味的气体,该气体主要是________,说明蛋白质中含有________元素。
(3)误食重金属盐会中毒,这是因为_______________________________ _________________________________________________________________________________________________________________。
(4)浓硝酸溅在皮肤上,使皮肤呈现________色,这是浓硝酸和蛋白质发生了________反应的缘故。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于自然界中氮循环(如右图)的说法不正 确的是:
确的是:
A、但元素均被氧化
B、工业合成氨属于人工固氮
C、含氮无机物和含氮有机物可相互转化
D、碳、氢、氧三种元素也参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
不能作为判断硫、氯两种元素非金属性强弱的依据是( )
A.单质氧化性的强弱 B.单质沸点的高低
C.单质与氢气化合的难易 D.最高价氧化物对应的水化物酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表
溶解度/(g/100g水)
|
化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为________,电池反应的离子方程式为________。
(2)维持电流强度为0.5
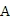 ,电池工作5分钟,理论上消耗锌________
,电池工作5分钟,理论上消耗锌________
 。(已知
。(已知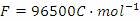
 )
)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有
 ,二者可通过_____分离回收;滤渣的主要成分是
,二者可通过_____分离回收;滤渣的主要成分是
 、_______和_______,欲从中得到较纯的
、_______和_______,欲从中得到较纯的
 ,最简便的方法为_________,其原理是_________。
,最简便的方法为_________,其原理是_________。
(4)用废电池的锌皮制备
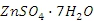 的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀
的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀
 溶解,铁变为______,加碱调节至pH为_______时,铁刚好沉淀完全(离子浓度小于
溶解,铁变为______,加碱调节至pH为_______时,铁刚好沉淀完全(离子浓度小于
 时,即可认为该离子沉淀完全);继续加碱至pH为_____时,锌开始沉淀(假定
时,即可认为该离子沉淀完全);继续加碱至pH为_____时,锌开始沉淀(假定
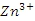 浓度为0.1mol
浓度为0.1mol
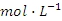 )。若上述过程不加
)。若上述过程不加
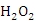 后果是______,原因是_______.
后果是______,原因是_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.Cl2通入NaOH溶液:
Cl2+OH-===Cl-+ClO-+H2O
B.NaHCO3溶液中加入稀盐酸:
CO +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:
Al3++4NH3·H2O===AlO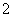 +4NH
+4NH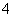 +2H2O
+2H2O
D.Cu溶于稀HNO3:
3Cu+8H++2NO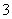 ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式: CuO + Al2O3 CuAlO2 + ↑
CuAlO2 + ↑
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com