
| A. | pH=0的溶液:Fe2+、Mg2+、NO3-、SO42- | |
| B. | 由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl- | |
| C. | 含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl- | |
| D. | pH=12的溶液:Na+、K+、〔Al(OH)4〕-、CO32- |
分析 A.pH=0的溶液呈酸性,硝酸根离子在酸性条件下能够氧化亚铁离子;
B.由水电离出的c(H+)=1×10-13mol/L的溶液为酸性或碱性,碳酸氢根离子与氢离子和氢氧根离子反应;
C.铁离子与硫氰根离子发生络合反应;
D.pH=12的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.pH=0的溶液显示酸性,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.由水电离出的c(H+)=1×10-13mol/L的溶液中存在大量氢离子或氢氧根离子,HCO3-与氢氧根离子、氢离子反应,在溶液中一定不能大量共存,故B错误;
C.Fe3+和SCN之间发生络合反应,在溶液中不能大量共存,故C错误;
D.pH=12的溶液呈碱性,Na+、K+、〔Al(OH)4〕-、CO32-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.


科目:高中化学 来源: 题型:选择题
| A. | CH2=CHCH2CH3和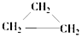 | B. |  和 和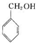 | ||
| C. | 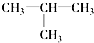 和CH3CH2CH2CH3 和CH3CH2CH2CH3 | D. | CH3CH2Cl与CH3CH2CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50 mL | B. | 100 mL | C. | 200 mL | D. | 300 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al3+、Mg2+、SO32- | B. | K+、CO32-、I- | C. | Al3+、CO32-、I- | D. | Na+、Br-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨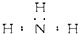 | |
| B. | 四氯化碳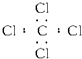 | |
| C. | 氮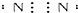 | |
| D. | 二氧化碳${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$C${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
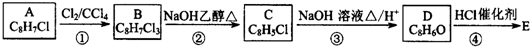
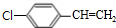 ,B中含有的官能团是氯原子.
,B中含有的官能团是氯原子.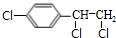 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$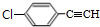 +2NaCl+2H2O,其反应类型为消去反应.
+2NaCl+2H2O,其反应类型为消去反应.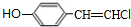 ;
;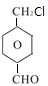 、
、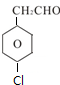 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨气化吸收大量热,可做制冷剂 | |
| B. | 晶体硅用于制作半导体材料是因其熔点高、硬度大 | |
| C. | 二氧化锰具有强氧化性,故能将双氧水氧化为氧气 | |
| D. | Fe比Cu活泼,所以FeCl3溶液可以腐蚀线路板上的Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | |||||
| 四 | J |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com