
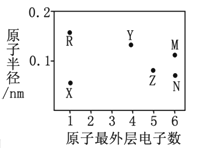
【题目】X、Y、Z、R、M、N为六种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。
(1)M元素的原子核外有__________种能量不同的电子,有__________个未成对电子;Z元素在元素周期表中的位置是第______周期________族。
(2)N、R、X三种元素的原子可构成一种强碱性物质,该物质的电子式是_____________;Y元素的氧化物是制造光纤的主要材料,该氧化物是________晶体(填晶体类型)。
某化工生产的核心环节的反应为:2MN2(g) + N2(g) 2 MN3(g) + Q(Q>0)
(3)该反应的平衡常数表达式K=__________________________;欲使K值变大,可采取的措施是__________________________。
(4)该反应达到平衡后,在其他条件不变的情况下,若使容器的体积扩大为原来的两倍,则平衡____________________。(选填“正向移动”、“逆向移动”或“不移动”)
【答案】 5 2 二 ⅤA ![]() 原子 [SO3]2/{ [SO2]2·[O2] } 降温 逆向移动
原子 [SO3]2/{ [SO2]2·[O2] } 降温 逆向移动
【解析】分析:X、Y、Z、R、M、N为六种短周期元素,X、R最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z原子最外层有5个电子,位于第VA族,M、N最外层有6个电子,位于第VIA族;R元素的原子半径最大,为Na元素,X元素的原子半径最小,为H元素;M元素的原子半径大于N,则M为S元素、N为O元素;Z的原子半径与N接近且大于N小于M,则Z为N元素,Y的原子半径大于M且小于R,则Y为Si元素。
详解:(1). S是16号元素,基态原子核外电子排布式为1s22s22p63s23p4,根据核外电子排布式可知,S原子有5种能量不同的电子,有2个未成对电子;N元素在元素周期表中的位置是第二周期ⅤA族,故答案为:5;2;二;ⅤA;
(2). O、Na、H三种元素构成的一种强碱性物质为NaOH,电子式为![]() ,Si元素的氧化物是SiO2,SiO2是制造光纤的主要材料,该氧化物是原子晶体,故答案为:
,Si元素的氧化物是SiO2,SiO2是制造光纤的主要材料,该氧化物是原子晶体,故答案为:![]() ;原子;
;原子;
(3). 某化工生产的核心环节的反应为:2SO2(g) + O2(g) 2 SO3(g) + Q(Q>0),由反应方程式可知,该反应的平衡常数表达式K=[SO3]2/{ [SO2]2·[O2] };因该反应为放热反应,欲使K值变大,可采取的措施是降温,故答案为:[SO3]2/{ [SO2]2·[O2] };降温;
(4). 该反应达到平衡后,在其他条件不变的情况下,若使容器的体积扩大为原来的两倍,则容器的压强减小,因减小压强平衡向气体增多的方向移动,所以该反应平衡逆向移动,故答案为:逆向移动。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铝和铁是生活中常见的两种金属。
(1)加热铝箔,铝融化但不滴落,原因是_________________________________________;用铝箔包住金属钠,用针在铝箔上刺些小孔,用镊子夹住放入水中,可能发生的反应用化学方程式表示为: ___________________________和__________________________________铝与盐酸反应的离子方程式为:__________________________________。
(2)在高温下,Fe与水蒸气可发生反应。应用下图装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
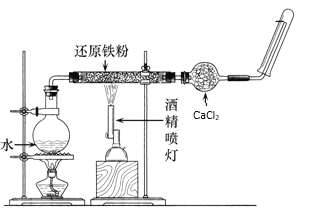
①写出该反应的反应方程式并用双线桥标出电子转转移方向和数目:______________________
②烧瓶底部放置了几片碎瓷片,碎瓷片的作用是________________________。
③酒精灯和酒精喷灯首先点燃的是__________________________。
④现欲将5.6 gFe完全溶解在稀硫酸中,加水后得200 mL溶液:所得硫酸亚铁溶液的物质的量浓度______________反应中转移的电子数是_________,生成的气体在标准状况下的体积是______________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)用绿矾晶体配制硫酸亚铁溶液时需加入少量铁粉,其目的是____________________,若绿矾失去了部分结晶水,会导致配制的溶液浓度__________(偏大、偏小、无影响)。
(2)设计实验检验绿矾晶体是否变质,写出实验方案:_______________________;
(3)若要检验硫酸铁溶液中是否含有Fe2+, 最好选用________________。
A.KSCN溶液、氯水 B. 酸性KMnO4溶液 C. NaOH溶液 D. H2O2溶液
(4)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(装置A)称重,记为m 1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m 2 g。按下图连接好装置进行实验。
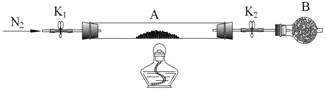
①仪器B的名称是____________________。
②用N2排净装置中的空气,加热装置A,使其彻底失去结晶水直至A恒重,记为m3 g。
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是2SO3(g) 2SO2(g) + O2(g) 的能量变化图,据图得出的相关叙述正确的是
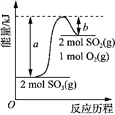
A. 2SO3(g) 2SO2(g) + O2(g) + (a-b) kJ
B. 1mol SO2的能量比1mol SO3的能量高
C. 若有2mol SO3充分反应,吸收(a-b) kJ热量
D. 该化学反应过程中的能量变化既有吸热又有放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:久置于潮湿环境中的漂白粉受热生成O2和少量Cl2;干燥的漂白粉加热后发生反应Ca(ClO)2![]() CaCl2 + O2↑。
CaCl2 + O2↑。
学生甲利用下图装置进行实验:加热A中试管内装有的潮湿漂白粉样品时,观察到B中有大量气泡产生。
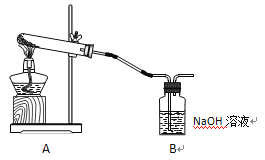
(1)B中发生反应的离子方程式为__________________________________________________。
(2)请写出实验室检验氯气的方法:_____________________________________________。
学生乙设计实验测定某干燥漂白粉样品中次氯酸钙的百分含量。实验步骤如下:
①称量坩埚的质量,为W1g。
②坩埚中加入样品后再称,质量为W2g。
③重复进行加热、冷却、称量,直到恒重,质量为W3g。
(3)称量所用仪器名称为_____________________;实验到达恒重的判断依据是___________________________________________________。
(4)该漂白粉样品中次氯酸钙的百分含量为_________________(用W1、W2、W3表示);若所用坩埚内壁沾有受热易分解的物质,则该实验测得的结果__________________。(选填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
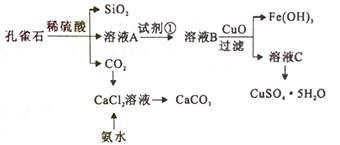
下列说法正确的是
A. 为将溶液A中的Fe2+氧化为Fe3+,试剂①可选用双氧水、氯气等
B. 流程中所加的CuO可以用Cu代替
C. 由溶液C获得CuSO4·5H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤等操作
D. 制备CaCO3时,应向CaCl2溶液中先通入CO2,再加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:

①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A. 阴极的电极反应:CO2+2H++2e-=CO+H2O
B. 协同转化总反应:CO2+H2S=CO+H2O+S
C. 石墨烯上的电势比ZnO@石墨烯上的低
D. 若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com