
分析 (1)相对分子质量与摩尔质量的数值相同,单位不同,摩尔质量单位为g/mol,利用n=$\frac{m}{M}$可计算物质的量,利用N=n×NA来计算分子数,利用V=n×Vm来计算体积;(2)根据n=$\frac{m}{M}$计算Na2SO4的物质的量,由化学式可知,钠离子物质的量为硫酸钠物质的量的2倍,硫酸根物质的量等于硫酸钠的物质的量;
(3)根据公式n=$\frac{m}{M}$来计算M,M在数值上等于元素的相对原子质量,分子的M在数值上等于其相对分子质量.
解答 解:(1)CO2的相对分子质量为12+16×2=44,则CO2的摩尔质量为44g/mol,88gCO2的物质的量为$\frac{88g}{44g/mol}$=2mol,其分子数为2mol×NAmol-1=2NA,在标准状况下的体积约为2mol×22.4L/mol=44.8L,故答案为:44g/mol;2mol;2NA;44.8L;
(2)71gNa2SO4的物质的量为$\frac{71g}{142g/mol}$=0.5mol,所含的Na+的物质的量是0.5mol×2=1mol,所含SO42-的物质的量等于硫酸钠的物质的量是0.5mol,所含SO42-的数目是0.5NA,故答案为:1mol;0.5NA(或3.01×1023);
(3)1.2gRSO4中含0.01molR2+,根据公式n=$\frac{m}{M}$,则RSO4的M=$\frac{m}{n}$=$\frac{1.2g}{0.01mol}$=120g/mol,RSO4的摩尔质量在数值上等于其相对分子质量,所以RSO4的摩尔质量为120g/mol,R的相对原子质量是120-32-64=24,故答案为:120g/mol;24.
点评 本题考查学生公式的运用以及分子的摩尔质量在数值上等于其相对分子质量这一结论,可以根据所学知识进行回答,较简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L | B. | 0.1mol/L | C. | 0.45mol/L | D. | 0.045mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
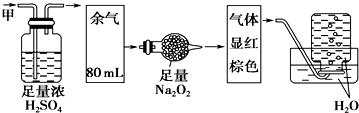
| A. | NH3、NO2、N2 | B. | NH3、NO、CO2 | C. | HCl、NO2、CO2 | D. | NO、CO2、N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{24n}{m-n}$ | B. | $\frac{n}{24(m-n)}$ | C. | $\frac{m-n}{8}$ | D. | $\frac{2(m-n)}{3n}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com