
【题目】氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物。
(1)NF3、NBr3、NCl3的沸点由高到低的顺序是______,这三种化台物中N原子的杂化类型是______,分子的空间构型是______
(2)N、F、Br三种元素的电负性由大到小顺序为____________
(3)叠氮酸(HN3)是一种弱酸。可部分电离出H+和N3-,请写出两种与N3-互为等电子体的分子______
(4)Fe2+、Cu2+、Co3+等过渡金属离子都能与叠氮化物、氰化物形成配合物。Fe2+的核外电子排布式为______;配合物[Co(N3)(NH3)5]SO4中Co的配位数为______,Co3+与NH3之间的作用力是______
(5)NaN3与KN3相比,NaN3的晶格能______KN3的晶格能(填“>”、“=”或“<”)+
(6)某元素X与N形成的氮化物中,X+中K、L、M三个电子层均充满了电子。它与N3-形成晶体的结构如图所示,X+的符号是______,晶体中每个N3-与其距离最近的X+有______个。

【答案】NBr3>NCl3>NF3 sp3杂化 三角锥形 F>N>Br N2O或CO2或CS2或BeCl2(任写两种) 1s22s22p63s23p63d6或[Ar]3d6 6 配位键 > Cu+ 6
【解析】
(1)根据分子晶体熔沸点的比较方法进行分析;计算中心原子的价电子对数可判断出中心原子杂化方式及分子空间构型;
(4)根据配合物[Co(N3)(NH3)5]SO4的结构判断配位数和作用力;
(5)根据钠离子和钾离子的半径可比较出NaN3与KN3的晶格能大小;
(6)根据X的核外电子排布特点推导出X元素的种类,再利用晶体结构图,看出晶体中每个N3-与其距离最近的X+的个数。
(1)NF3、NBr3、NCl3都是分子晶体,且组成结构相似,它们的相对分子质量的大小关系为:NBr3>NCl3>NF3,所以它们的沸点由高到低的顺序是:NBr3>NCl3>NF3;在这三种化合物中,每个氮原子都和其它三个原子形成3个σ键,另外还有一对孤电子对,所以氮原子均采取sp3杂化,由于有一对孤电子对,所以它们都是三角锥形,故答案为:NBr3>NCl3>NF3;sp3杂化;三角锥形;
(2)F的电负性最大,N与Cl电负性相当,Br的电负性比Cl的电负性小,则N、F、Br三种元素的电负性由大到小顺序为F>N>Br;
(3)N3-中有三个原子,价电子总数为16,根据等电子体原理可知,与它互为等电子体的分子有:N2O、CO2、CS2、BeCl2,故答案为:N2O或CO2或CS2或BeCl2(任写两种);
(4)铁为26号元素,Fe2+的核外电子排布式为:1s22s22p63s23p63d6或[Ar]3d6,在配合物[Co(N3)(NH3)5]SO4中,一个N3-和5个NH3都是配体,分别与钴离子形成配位键,所以钴离子的配位数是6,Co3+与NH3之间的作用力是配位键;
(5)因为钠离子的半径比钾离子的半径小,所以NaN3的晶格能比KN3的晶格能大;
(6)X+中K、L、M三个电子层均充满了电子,所以X+核外有28个电子,即X为铜元素,X+为Cu+,根据晶体结构图可知,每个N3-与其距离最近的Cu+有6个。


科目:高中化学 来源: 题型:
【题目】下列关于蔗糖属于非还原性糖,而其水解产物具有还原性的实验方案的说法正确的是( )。

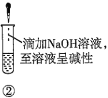


A.验证蔗糖属于非还原性糖的操作顺序:④③
B.验证蔗糖風于非还原性糖的操作顺序:④②③
C.验证蔗糖水解产物具有还原性的操作顺序:①④⑤
D.验证蔗糖水解产物具有还原性的操作顺序:①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )
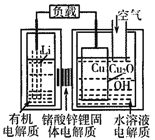
A. 放电时,当电路中通过0.1 mol电子的电量时,有0.1molLi+透过固体电解质向Cu极移动,有标准状况下1.12L氧气参与反应
B. 整个反应过程中,氧化剂为O2
C. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
D. 通空气时,铜被腐蚀,表面产生Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.12g NaHSO4晶体中阳离子和阴离子的总数为0.3NA
B.密闭容器中2 mol NO与1mol O2充分反应,产物的分子数目为2NA
C.在一定条件下,6.4g铜与过量的硫反应,转移的电子数目为0.2NA
D.10g质量分数为46%的乙醇溶液中O-H键数目为0.7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。已知在25℃、101kPa下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )
A. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+534kJ·mol-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出)。回答下列有关问题:
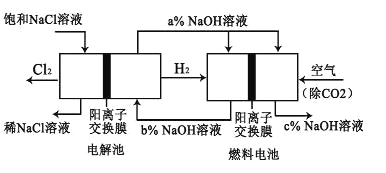
(1)电解池的阴极反应式为_____________。
(2)通入空气一极的电极反应式为_____________。燃料电池中阳离子的移动方向是_____________ (“从左向右”或“从右向左”)。
(3)电解池中产生 2molCl2,理论上燃料电池中消耗标准状况下_____________LO2。
(4) a、b、c 由大到小的顺序为:_____________。
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,可由 KClO3在H2SO4存在下与 Na2SO3反应制得。请写出反应的离子方程式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 | A | B | C | D | E |
最低化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的简单氢化物的稳定性:C>D>E
B.元素A的原子最外层中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法全部正确的是( )
①环丙烷和乙烯的最简式相同②相同质量的乙炔和苯充分燃烧耗氧量相同
③苯乙烯和丁烯互为同系物④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2 L的己烷所含的分子数为0.5NA(NA为阿伏加德罗常数的值)
⑥![]() 分子中所有原子一定都在同一平面上
分子中所有原子一定都在同一平面上
A. ①②③B. ②④⑤⑥
C. ①②④D. ①②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com