
【题目】氮、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物用途广泛。回答下列问题:
(1)基态P原子的核外电子排布式为___________________
(2)自然固氮现象发生的一系列化学变化:![]() ,解释了民谚“雷雨发庄稼”的原理。
,解释了民谚“雷雨发庄稼”的原理。
①![]() 分子结构中σ键和π键数目之比为__________
分子结构中σ键和π键数目之比为__________
②![]() 中N原子采取__________杂化方式,写出它的一种等电子体的化学式:__________。
中N原子采取__________杂化方式,写出它的一种等电子体的化学式:__________。
③已知酸性:![]() ,下列相关见解合理的是__________。
,下列相关见解合理的是__________。
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.![]() 中氮元素的正电性更高,在水溶液中更易电离出
中氮元素的正电性更高,在水溶液中更易电离出![]() ,酸性强于
,酸性强于![]()
(3)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,图中a点和b点的原子坐标参数分别为(0,0,0)、![]() ,则c点的原子坐标参数为__________。已知该晶体密度为
,则c点的原子坐标参数为__________。已知该晶体密度为![]() ,则B—P键的键长为__________pm(阿伏加德罗常数用
,则B—P键的键长为__________pm(阿伏加德罗常数用![]() 表示,列出计算式即可)。
表示,列出计算式即可)。
 。
。
【答案】![]() 1∶2 sp2 SO3或O4或BF3等 BC
1∶2 sp2 SO3或O4或BF3等 BC ![]()
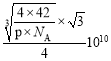
【解析】
(1).P元素的原子序数为15,核外电子为3层,有5个能级;
(2)①N2分子中含有氮氮三键,结构式为N≡N,氮氮三键由一个σ键和两个π键形成;
②硝酸根中N原子价电子层电子对数为3,孤电子对数为0,杂化方式为sp2杂化;原子个数和价电子数相同的微粒互为等电子体;
③同种元素化合价越高,含氧酸中氧原子总数越多,非羟基氧原子个数越多,正电性更高,在水溶液中更易电离出![]() ,酸性越强;
,酸性越强;
(3)由a、b的坐标可知晶胞的边长为1,由晶胞结构可知c位于右侧面的面心,则c的坐标为(1, ![]() ,
, ![]() );由分摊法计算可得。
);由分摊法计算可得。
(1).P元素的原子序数为15,核外电子为3层,有5个能级,电子排布式为1s22s22p63s23p3,故答案为:1s22s22p63s23p3;
(2)①N2分子中含有氮氮三键,结构式为N≡N,氮氮三键由一个σ键和两个π键形成,则σ键和π键之比为1:2,故答案为:1:2;
②硝酸根中N原子价电子层电子对数为3,孤电子对数为0,则杂化方式为sp2杂化;原子个数和价电子数相同的微粒互为等电子体,则与硝酸根互为等电子体的微粒为SO3或O4或BF3等,故答案为:SO3或O4或BF3等;
③A.含氧酸中非羟基氧原子个数越多,酸性越强,与氧原子总数无关,故错误;
B.同种元素化合价越高,含氧酸中氧原子总数越多,非羟基氧原子个数越多,酸性越强,故正确;
C. HNO3中氮元素的化合价高,正电性更高,在水溶液中更易电离出![]() ,所以相较HNO2酸性更强,故正确;
,所以相较HNO2酸性更强,故正确;
BC正确,故答案为:BC;
(3)由a、b的坐标可知晶胞的边长为1,由晶胞结构可知c位于右侧面的面心,则c的坐标为(1, ![]() ,
, ![]() );由晶胞结构可知,b处于4个P原子围成的正方体的正中心,P原子位于顶点,设x为晶胞边长,则B-P键的长度为
);由晶胞结构可知,b处于4个P原子围成的正方体的正中心,P原子位于顶点,设x为晶胞边长,则B-P键的长度为![]() ;由晶胞结构可知,晶胞中含有4个BP ,由
;由晶胞结构可知,晶胞中含有4个BP ,由![]() =x3ρ可得x=
=x3ρ可得x=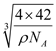 ,则B-P键长为
,则B-P键长为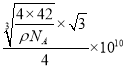 pm,故答案为:(1,
pm,故答案为:(1, ![]() ,
, ![]() );
); 。
。
![]()


科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:
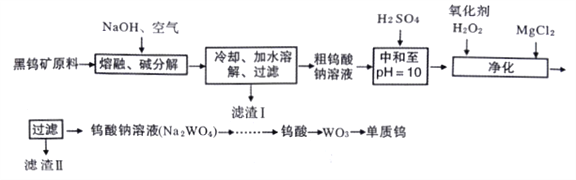
已知:
①滤渣I的主要成份是Fe2O3、MnO2。
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为____,请写出MnWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式__________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为____,滤渣Ⅱ的主要成分是____。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
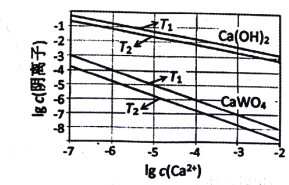
①T1 _____T2(填“>”或“<”)T1时Ksp(CaWO4)=____。
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置。请根据该装置回答下列问题:
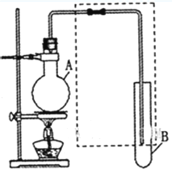
(1)若用乙醇与乙酸反应制取乙酸乙酯,则烧瓶A中加入的试剂在混合时的操作方法是___________,反应的化学方程式为___________,试管B中应加入___________。虚线框中的导管除用于导气外,还兼有___________作用。
(2)若用该装置分离乙酸和1-丙醇,则在烧瓶A中除加入1-丙醇与乙酸外,还应先加入适量的试剂___________,加热到一定温度,试管B中收集到的是(填写化学式)___________。冷却后,再向烧瓶中加入试剂___________再加热到一定温度,试管B中收集到的是___________(填写化学式)。
(3)若用该装置(不用加热)证明酸性:醋酸>碳酸>苯酚,则在烧瓶A中加入___________,试管B中应加入___________。
(II)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛,发生:CH3CH2CH2CH2OH→![]() CH3CH2CH2CHO。
CH3CH2CH2CHO。
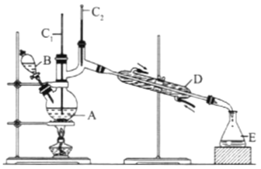
反应物和产物的相关数据列表:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 11.72 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由:__________。
(2)加入沸石的作用是__________;若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,B仪器的名称是__________,D仪器的名称是__________。
(4)分液漏斗使用前必须进行的操作是(填字母)__________。
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,水在__________层(填“上”,或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________。
(7)本实验中,正丁醛的产率为__________%。.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝和铁是三种重要的金属,回答问题:
(1)三种金属中,既能与盐酸反应又能与![]() 溶液反应_________(填化学式),写出它与
溶液反应_________(填化学式),写出它与![]() 溶液反应的离子方程式_________________。
溶液反应的离子方程式_________________。
(2)三种金属在一定条件下均能与水发生反应。写出铁与水蒸气反应的化学方程式__________。取一小块金属钠放入滴有酚酞的水中,可观察到的实验现象是_______________。(填字母序号)。
①钠浮在水面迅速反应
②钠沉在水底迅速反应
③钠熔成小球并迅速游动
④反应中可以听到嘶嘶的响声
⑤反应后的溶液变为红色
A.①④⑤ B.②③④⑤ C.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金是用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
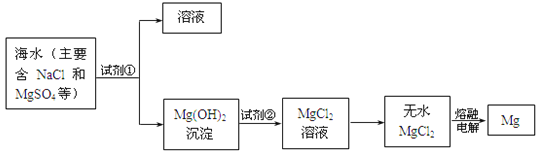
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用_________;
(2)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为__________________;
(3)电解后产生的副产物氯气可用于工业制漂白粉。某兴趣小组模拟工业制漂白粉,设计了下图的实验装置。
已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
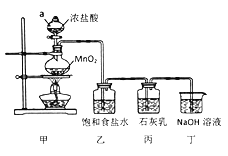
回答下列问题:
①甲装置中仪器a的名称是____________________;
②装置乙中饱和食盐水的作用是__________________________________;
③制取漂白粉的化学方程式是_____________________________________;
④该小组制得的漂白粉中n(CaCl2)远大于n(Ca(ClO)2],其主要原因是_________;
⑤为提高丙中Ca(ClO)2的含量,可采取的措施是_______________(任写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是
A. ![]() 苯环上的一氯取代物有5种
苯环上的一氯取代物有5种
B. 丁烷(C4H10)的二氯取代物最多有4种
C. 菲的结构简式为 ,其一硝基取代物有10种
,其一硝基取代物有10种
D.  和
和 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )

A. 当有0.8mol电子转移时,b极产生4.48LO2
B. 为了增加导电性可以将左边容器中的水改为NaOH溶液
C. d极上发生的电极反应是:2H+ +2e-=H2
D. c极上进行氧化反应,A池中的H+可以通过隔膜进入B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com