
| A. | N 2为0.2 mol•L-1,H 2为0.6 mol•L-1 | |
| B. | N 2为0.15 mol•L-1 | |
| C. | N 2、H 2均为0.18 mol•L-1 | |
| D. | NH 3为0.4 mol•L-1 |
分析 化学平衡研究的对象为可逆反应.化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值;N2和H2的浓度之比始终满足1:3,二者化学计量数为1:3,所以不可能均为0.18mol/L.
解答 解:反应N2(g)+3H2(g)?2NH3(g)为可逆反应,转化率不可能为100%,根据化学计量数及极值法考虑:N2的范围在(0,0.2),H2的范围在(0,0.6),而NH3可以(0,0.4),
A、氨气不可能完全转化,所以氮气浓度小于0.2 mol/L,氢气浓度小于0.6 mol/L,故A错误;
B、氮气的浓度范围为(0,0.2),氮气为0.15mol/L在该范围内,故B正确;
C、N2和H2的浓度之比始终满足1:3,二者化学计量数为1:3,所以不可能均为0.18mol/L,故C错误;
D、氨气的浓度范围为:(0,0.4),氮气和氢气不可能完全转化生成氨气,故D错误;
故选B.
点评 本题考查了可逆反应的特点,题目难度不大,转移明确可逆反应中反应物转化率不可能为100%,该题是高考中的常见题型,注重基础,侧重考查学生分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
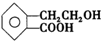 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.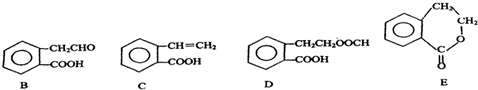
 .
. +2NaOH→
+2NaOH→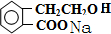 +HCOONa+H2O.
+HCOONa+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
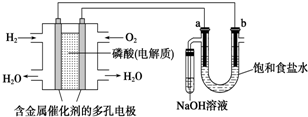
| A. | 电池工作时,正极反应式为:O2+2 H2O+4e-=4OH- | |
| B. | 忽略能量损耗,当电池中消耗0.1g H2时,b极周围会产生1.12L H2 | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 电解时,a 电极周围首先放电的是Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O晶体与氯化铵固体的反应 | |
| B. | 氢氧化钠溶液与盐酸反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | 高温煅烧石灰石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com