
| A. | 增大压强 | B. | 升高温度 | C. | 增大CH4浓度 | D. | 更换高效催化剂 |
分析 可逆反应CH4(g)+CO2(g)?2CO(g)+2H2(g)△H>0为气体体积缩小的吸热反应,若提高CH4的转化率,必须使平衡向着正向移动,可以减小压强、升高温度或增大二氧化碳浓度,据此进行解答.
解答 解:A.该反应为气体体积缩小的反应,增大压强后平衡向着逆向移动,甲烷的转化率减小,故A错误;
B.该反应为吸热反应,升高温度后平衡向着正向移动,增大了甲烷的转化率,故B正确;
C.增大甲烷的浓度,平衡向着正向移动,但是甲烷的转化率反而减小,故C错误;
D.催化剂只影响反应速率,不影响化学平衡,故D错误;
故选B.
点评 本题考查了化学平衡的影响因素,题目难度不大,明确温度、压强、浓度等条件对化学平衡的影响为解答关键,D为易错点,注意催化剂不影响化学平衡,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 制乙烯时,用排水法或向上排空气法收集气体 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| C. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
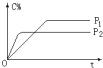 可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )
可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )| A. | P1>P2,n>3 | B. | P1>P2,n<3 | C. | P1<P2,n<3 | D. | P1<P2,n>3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| B. | 使用天然气热水器取代电热水器 | |
| C. | 推荐使用手帕,尽量减少使用面纸 | |
| D. | 在建筑、布展、运营过程中应用大规模的太阳能光伏发电系统 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯、环己烷都属于脂肪烃 | B. | 苯、环戊烷、环己烷同属于芳香烃 | ||
| C. | 乙烯、乙炔同属于烯烃 | D. |  、 、 、 、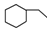 同属于环烷烃 同属于环烷烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com