
| Ԫ�ش��� | A | B | D | E | G | H | I | J |
| ���ϼ� | -1 | -2 | +4��-4 | -1 | +5��-3 | +3 | +2 | +1 |
| ԭ�Ӱ뾶/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A�� | A�ĵ����ܽ�E���ʴ�HE����Һ���û����� | |
| B�� | A��H��J�����Ӱ뾶�ɴ�С˳����A��J��H | |
| C�� | GԪ�صĵ��ʲ�����ͬ�������� | |
| D�� | I��DB2��ȼ���������ֻ����� |
���� ����Ԫ�ص��������=�������������������+|�����|=8�������=����������-8��ͬ����Ԫ��ԭ�Ӵ�����ԭ�Ӱ뾶��С��ͬ����Ԫ��ԭ�Ӱ뾶���ϵ�����������֪��AΪF��BΪO��DΪC��EΪCl��GΪP��HΪAl��IΪBe��JΪNa��
A���õ�������ǿ�ķǽ����������û��õ����������ģ�
B�����Ӳ�Խ�࣬�뾶Խ���Ӳ�һ�����˵����Խ��뾶ԽС��
C��ͬ����������ͬ��Ԫ����ɵ����ʲ�ͬ�ĵ���֮��Ļ��ƣ�
D��ͬ����Ԫ�ؾ��������ԣ����þ�������̼�ķ�Ӧ������
��� �⣺Ԫ�ص��������=�������������������+|�����|=8�������=����������-8��ͬ����Ԫ��ԭ�Ӵ�����ԭ�Ӱ뾶��С��ͬ����Ԫ��ԭ�Ӱ뾶���ϵ�����������֪��AΪF��BΪO��DΪC��EΪCl��GΪP��HΪAl��IΪBe��JΪNa��
A��F2����ˮ��Ӧ�û�����������A�ĵ��ʲ��ܽ�E���ʴ�HE3����Һ���û���������A����
B��A��J��H�ֱ�ΪF��Na��Al�����ǵ����Ӻ�����Ӳ�����ȣ����Ӱ뾶��С˳��Ϊ��F-��Na+��Al3+����B��ȷ��
C�����Ͱ���Ϊͬ�������壬��C����
D���������þ������ʶ���ڶ�����̼�е�ȼ�������������̼���ʣ��������ֻ������D����
��ѡB��
���� ���⿼����λ�á��ṹ�����ʹ�ϵ���ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ����ݸ��ݱ���������ȷ�жϸ�Ԫ������Ϊ���ؼ���ע������ԭ�ӽṹ��Ԫ�����ڱ���Ԫ�������ɵĹ�ϵ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͭƬ�еμ�Ũ���Ტ���ȣ��д̼�����ζ���������Cu+4H++SO42- $\frac{\underline{\;\;��\;\;}}{\;}$Cu2++SO2��+2H2O | |
| B�� | ���ð�˾ƥ�ֹ�������ˮ���ᣨ ���ж���Ӧ���ɾ���ע��NaHCO3��Һ�� ���ж���Ӧ���ɾ���ע��NaHCO3��Һ�� +2 HCO3-��+2 CO2��+2 H2O +2 HCO3-��+2 CO2��+2 H2O | |
| C�� | 20mL 1.0mol/L��������Һ��10mL 3.5mol/LBa��OH��2��Һ��ϳ�ַ�Ӧ��3Ba2++6OH-+2Al3++3SO42-�T3BaSO4��+2Al��OH��3�� | |
| D�� | ��Ca��HCO3��2��Һ�м������NaOH��Һ���а�ɫ�������ɣ�Ca2++2HCO3-+2OH-�TCaCO3��+2H2O+CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NO2��Cl2O7�������������� | B�� | ˮ����ˮ�������ǻ���� | ||
| C�� | HD��HCHO���Ǽ��Է��� | D�� | �ɱ�����ȼ�����Ƿ��Ӿ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ���������μ�����������Һ | |
| B�� | �����������Ũ�ȵ�ϡ�����зֱ�����п�ۺ����� | |
| C�� | �õ���������Ũ�ȵĹ���������Һ�������������������� | |
| D�� | ��һ�������Ȼ�ͭ��ϡ����Ļ����Һ����μ�������������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PVC�ĵ�����CH3CH2Cl | |
| B�� | PVC�Ǹ߷��ӻ����� | |
| C�� | PVC�ܹ�ʹ������Ȼ�̼��Һ��ɫ | |
| D�� | PVC����Ĥ���ʺ�������װ�߲ˡ�ˮ������ʳ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
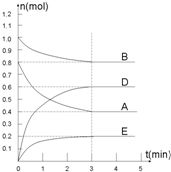
| A�� | ��Ͷ��2molA��1molB | B�� | �����������ͨ��1molB | ||
| C�� | �Ƴ���������B | D�� | ��Ͷ��2molA��1molB��0.6molD |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ͼ��ʾ�����缫һΪ̼����һΪ��Ƭ����������ָ�뷢��ƫת����a�����д����������ɣ�������������ȷ���ǣ�������
��ͼ��ʾ�����缫һΪ̼����һΪ��Ƭ����������ָ�뷢��ƫת����a�����д����������ɣ�������������ȷ���ǣ�������| A�� | aΪ����������Ƭ���ձ��е���ҺΪϡ������Һ | |
| B�� | bΪ����������Ƭ���ձ��е���ҺΪ����ͭ��Һ | |
| C�� | aΪ��������̼�����ձ��е���ҺΪϡ������Һ | |
| D�� | bΪ��������̼�����ձ��е���ҺΪ����ͭ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
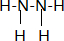
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com