
【题目】下列说法正确的是( )
A.常温下,![]() 固体在
固体在![]() 溶液中的
溶液中的![]() 比在
比在![]() 中的
中的![]() 大
大
B.恒温恒容的密闭容器中,某储氢反应:![]() ,当容器内气体压强保持不变时,反应达到化学平衡
,当容器内气体压强保持不变时,反应达到化学平衡
C.铝-空气燃料电池,以![]() 溶液为电解液时负极反应为:
溶液为电解液时负极反应为:![]()
D.常温下,相同浓度的碳酸钠与碳酸氢钠的混合溶液中离子浓度的大小顺序为:![]()
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )
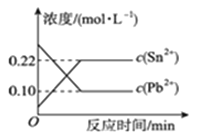
A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D. 25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -26.7kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -50.75kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= -36.5 kJ·mol-1
则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为
A.+7.28kJ·mol-1B.7.28kJ·mol-1
C.+43.68kJ·mol-1D.43.68kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。
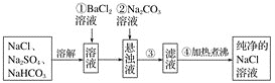
如果此方案正确,那么:
(1)操作①为什么不用硝酸钡溶液,其理由是___________________________________。
(2)进行操作①后,如何判断SO![]() 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(3)操作②的目的是________,为什么不先过滤后加碳酸钠溶液?理由是________________________________________________________________________。
(4)操作③用到的玻璃仪器除烧杯、玻璃棒外,还需要____________________。
(5)操作④的目的是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已有知识判断下列说法正确的是( )
A.若X是第四周期中的一种“类硅”元素,则X单质不易与水反应
B.若![]() 与
与![]() 电子层结构相同,则原子序数
电子层结构相同,则原子序数![]() ,离子半径
,离子半径![]()
C.若①氯化钠溶液与②氯化铵溶液浓度相等,则常温下两种溶液中的Kw:②>①
D.若反应![]() 在一定条件下能够自发进行,则反应的
在一定条件下能够自发进行,则反应的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);△H= +mkJ/mol(m>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
Si(s)+4HCl(g);△H= +mkJ/mol(m>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为m kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025m kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有硫酸钠和碳酸钠混合溶液10.0 mL,加入足量氯化钡溶液,充分反应后,经过滤、洗涤和干燥,得到白色沉淀1.451 g。将沉淀与过量盐酸反应,得到112 mL 二氧化碳气体(在标准状况下)。求原混合溶液中硫酸钠和碳酸钠的物质的量浓度分别是多少?________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大。A单质是密度最小的气体。B是周期表已知元素中非金属性最强的元素,且和C属同一主族。D、E、F属同一周期,D、F为主族元素,又知E、F的原子序数分别是29、33。D跟B可形成离子化合物,其晶胞结构如图:
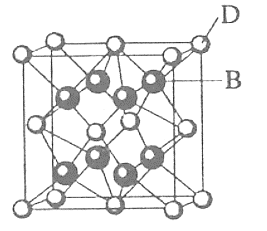
(1)比C元素质子数少1的原子的价层电子的轨道表示式为__________。
(2)E元素在周期表中第_____周期,第_____族的元素,它的+2价离子的电子排布式为________。写出E的单质与稀硝酸反应的离子方程式___________。
(3)F元素的名称是_____。与F同一主族的第二、三周期元素与A形成的化合物沸点的高低为___________>__________(用化学式表示),判断的理由____________。
(4)写出D跟A形成的化合物的电子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将7.68g铜与50mL一定浓度的硝酸恰好完全反应,收集到标准状况下4.48L气体。
请回答:
(1)NO的体积为__L,NO2的体积为__L;
(2)被还原的硝酸的物质的量是__mol;
(3)硝酸的物质的量浓度是__mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com