
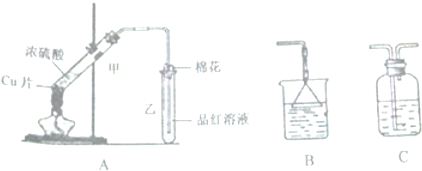
分析 (1)浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫属于有毒气体,要进行尾气处理;
(3)SO2具有漂白性,可使品红溶液褪色;
(4)亚硫酸钙中+4价S具有还原性;
(5)二氧化硫的溶解度很大,用溶液吸收二氧化硫时要防倒吸;
(6)随着反应的进行,硫酸浓度不断降低,稀硫酸与铜不反应.
解答 解:(1)浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应,生成二氧化硫、硫酸铜和水,其反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫属于有毒气体,要进行尾气处理,一般用氢氧化钠溶液吸收二氧化硫,其反应的离子方程式为:SO2+2OH-=SO32-+H2O;
故答案为:吸收有毒的尾气,防止污染大气;SO2+2OH-=SO32-+H2O;
(3)SO2具有漂白性,可使品红溶液褪色,当乙中品红褪色,说明反应中生成了二氧化硫,即Cu与浓硫酸发生反应;
故答案为:褪色;漂白;
(4)生石灰与二氧化硫反应生成亚硫酸钙,亚硫酸钙中+4价S具有还原性,在加热条件下,能被氧气氧化为硫酸钙;
故答案为:亚硫酸钙中+4价S具有还原性,能被氧气氧化为硫酸钙;
(5)为了防止二氧化硫造成空气污染,如果需要在末端增加尾气吸收装置,由于二氧化硫的溶解度很大,用溶液吸收二氧化硫时要防倒吸,所以应该选用B;
故答案为:B;
(6)浓硫酸具有强氧化性,而稀硫酸与铜不反应,随着反应的进行,硫酸浓度不断降低,稀硫酸与铜不反应,则反应后溶液中一定含有硫酸,
故答案为:反应过程中浓H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应..
点评 本题综合考查性实验设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握相关物质的性质以及实验原理.


科目:高中化学 来源: 题型:解答题
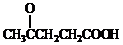 )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):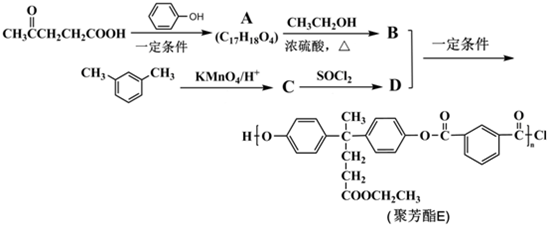
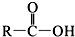 +SOCl2→
+SOCl2→ +SO2+HCl
+SO2+HCl +R′OH→
+R′OH→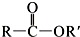 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)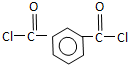 .
.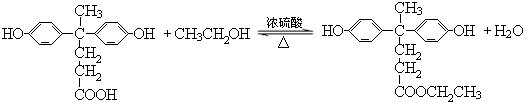 ,.
,.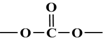 结构写出F与足量NaOH溶液共热反应的化学方程式:
结构写出F与足量NaOH溶液共热反应的化学方程式: .
.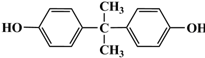 的路线.
的路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
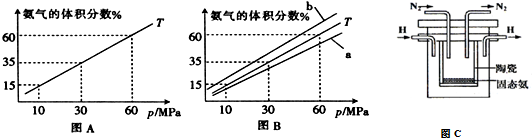
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下:
日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
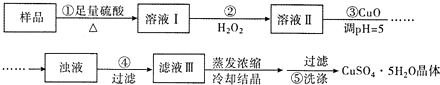
| A. | 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| B. | 步骤②可用氯水、硝酸等强氧化剂代替H2O2 | |
| C. | 步骤③用 CuCO3代替CuO也可调节溶液的pH | |
| D. | 步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 草酸钪络盐 | 温度区间(K) | 质量(g) |
| Sc2(C2O4)3•6H2O | 298 | 0.462 |
| 383~423 | 0.372 | |
| 463~508 | 0.354 | |
| 583~873 | 0.138 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
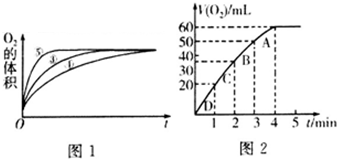
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;
; 、和
、和 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com