
【题目】铁元素存在多种硫化物,兴趣小组为测定某铁硫化物(FeaSy)的组成按下列流程进行探究:
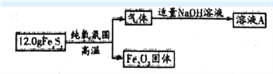
回答下列问题:
(1)测得Fe2O3固体的质量为8.0g,则FeaSy的化学式为______________。请设计实验检验Fe2O3中含有+3价铁:__________________________。
(2)铁硫化物在纯氧中发生反应的化学方程式为______________________________。
(3)兴趣小组同学推测溶液A中除含有Na2SO3外,还可能含有Na2SO4。设计实验方案并探究:
①用0.10 mol·L-1酸性KMnO4溶液应盛装在_______________(填“酸式“或“碱式”)滴定管中,然后进行滴定,反应的离子方程式为_________________________。
②确认A溶液中是否含有Na2SO4

请用化学方程式解释该方案不合理的原因____________________________________。
【答案】 FeS2 取少量固体Fe2O3于试管中,向试管中加入适量稀盐酸使固体溶解,滴加KSCN溶液,溶液变为血红色。或取少量Fe2O3固体于试管中,向试管中加入适量稀盐酸使固体溶解,滴加K4[Fe(CN)6]溶液,产生蓝色沉淀 4FeS2+11O2![]() Fe2O3+8SO2 酸式 2MnO4-+5SO32-+6H+=5SO42-+2Mn2++3H2O 3BaSO3+2HNO3=3BaSO4+2NO↑+H2O
Fe2O3+8SO2 酸式 2MnO4-+5SO32-+6H+=5SO42-+2Mn2++3H2O 3BaSO3+2HNO3=3BaSO4+2NO↑+H2O
【解析】本题考查Fe及其化合物。主要涉及的考点计算、离子方程式的书写、铁离子的检验。(1)8.0g Fe2O3 中为含Fe的质量为![]() =5.6g,故12.0 FeaSy中S的质量为12.0g-5.6g=6.4g,故n(Fe):n(S)=
=5.6g,故12.0 FeaSy中S的质量为12.0g-5.6g=6.4g,故n(Fe):n(S)= ![]() =1:2,故FeaSy的化学式为FeS2;检验+3价铁,需要用KSCN溶液或K4[Fe(CN)6]溶液,故其方法为:取少量固体Fe2O3于试管中,向试管中加入适量稀盐酸使固体溶解,滴加KSCN溶液,溶液变为血红色。或取少量Fe2O3固体于试管中,向试管中加入适量稀盐酸使固体溶解,滴加K4[Fe(CN)6]溶液,产生蓝色沉淀;(2)FeS2与氧气反应生成Fe2O3和8SO2,方程式为4FeS2+11O2
=1:2,故FeaSy的化学式为FeS2;检验+3价铁,需要用KSCN溶液或K4[Fe(CN)6]溶液,故其方法为:取少量固体Fe2O3于试管中,向试管中加入适量稀盐酸使固体溶解,滴加KSCN溶液,溶液变为血红色。或取少量Fe2O3固体于试管中,向试管中加入适量稀盐酸使固体溶解,滴加K4[Fe(CN)6]溶液,产生蓝色沉淀;(2)FeS2与氧气反应生成Fe2O3和8SO2,方程式为4FeS2+11O2![]()
![]() Fe2O3+8SO2;(3)①酸性KMnO4溶液具有强氧化性,故应装在酸式滴定管中,然后进行滴定,滴定时,MnO4-将SO32-氧化为SO42-,自身被还原为Mn2+,反应的离子方程式为:2MnO4-+5SO32-+6H+=5SO42-+2Mn2++3H2O;②确认A溶液中是否含有Na2SO4方案不合理,因稀硝酸具有强氧化性,能将SO32-氧化为SO42-,其反应方程式为:3BaSO3+2HNO3=3BaSO4+2NO↑+H2O。
Fe2O3+8SO2;(3)①酸性KMnO4溶液具有强氧化性,故应装在酸式滴定管中,然后进行滴定,滴定时,MnO4-将SO32-氧化为SO42-,自身被还原为Mn2+,反应的离子方程式为:2MnO4-+5SO32-+6H+=5SO42-+2Mn2++3H2O;②确认A溶液中是否含有Na2SO4方案不合理,因稀硝酸具有强氧化性,能将SO32-氧化为SO42-,其反应方程式为:3BaSO3+2HNO3=3BaSO4+2NO↑+H2O。


科目:高中化学 来源: 题型:
【题目】某学习小组在实验室制取CO2气体的过程中,不慎用到了浓盐酸,导致制得的CO2气体中混有氯化氢气体,他们设计了如下除去氯化氢气体并探究CO2与过氧化钠(Na2O2)反应的实验. 查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2、H2O发生反应:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2H2O═4NaOH+O2↑
请回答下列问题: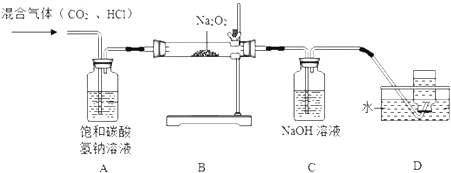
(1)装置A的作用是 .
(2)为确定反应后装置B硬质玻璃管中固体的成分,小组同学取适量固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含 , 该小组同学继续进行探究.
(3)【提出问题】反应后硬质玻璃管中固体的成分是什么? 【做出猜想】猜想一:Na2CO3猜想二:NaOH 猜想三:Na2CO3和NaOH
经过讨论,大家一致认为猜想不合理,理由是 .
(4)【实验验证】小组同学取上述形成的溶液M于试管中,向其中加入过量的溶液,若产生白色沉淀,过滤,向滤液中滴加几滴酚酞试液,溶液变红,则证明猜想三成立.
(5)【交流反思】小组中有同学认为,将上述滤液中滴加的酚酞试液换成硝酸铜溶液,也能得出同样的结论, 你认为该同学的观点(填“正确”或“错误”),理由是 .
(6)【拓展延伸】在盛有氯化铵(NH4Cl)浓溶液的试管中,加入足量的过氧化钠(Na2O2)固体,有气泡产生,产生的气体是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含NA个氮原子
C.2 L 0.3 molL﹣1 Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒
B.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣个数为1NA
C.25℃,1.01×105Pa,11.2L Cl2含有的分子数小于0.5NA
D.常温下,23 g NO2含有2NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对 空气与地面进行消毒.
(1)配制 220mL0.05mol/L 的过氧乙酸溶液,需使用的仪器有:烧杯、量筒、玻璃棒胶头滴管及
(2)配制过程中,可能引起浓度偏高的操作有 ;
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.转移溶液时,不慎有少量溶液洒在容量瓶外
C.定容时,俯视容量瓶刻度线进行定容
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线
(3)下列叙述正确的是 (填字母)
A.可用过滤的方法将过氧乙酸溶液中混有的 NaCl 除掉
B.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
C.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(4)过氧乙酸半小时内会完全分解生成乙酸(CH3COOH)和一种常见的气体单质,检验该气体单质的实验方法是
(5)如果生产过氧乙酸的原料 CH3COONa 中混有了 SO42﹣ , 要想除掉 SO42﹣请选择下列试剂按照加入先后顺序填空(试剂不必选完,填序号即可)
①盐酸 ②醋酸钡溶液 ③氯化钡溶液 ④醋酸 ⑤碳酸钠溶液 ⑥碳酸氢钠溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)实验室有如下仪器:①试管 ②烧杯 ③量筒 ④蒸发皿 ⑤坩埚 ⑥温度计 ⑦蒸馏烧瓶,其中可以直接加热的玻璃仪器有(填序号)
(2)4.5g水与g磷酸(H3PO4)所含的分子数相等,它们所含的氧原子数之比是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0. 20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为__________________________,表中b_________c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为__________________mol·L-1,0~20s内N2O4的平均反应速率为________________;
(3)该反应的平衡常数表达式K=___________________
在80℃时该反应的平衡常数K值为:______________(保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时____________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酶的叙述错误的是( )
A.绝大多数酶是具有催化作用的蛋白质
B.酶的催化作用具有选择性和专一性
C.高温会使酶失去活性
D.酶只有在强酸性或强碱性条件下才能发挥作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。

实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com