
| A. | HCO3-、Na+、OH-、K+ | B. | CO32-、Ba2+、K+、NO3- | ||
| C. | Ba2+、OH-、Cl-、Na+ | D. | CO32-、Na+、NO3-、H+ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
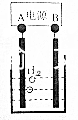 用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.| A. | 图中电源的A极为直流电源的负极 | |
| B. | 加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性 | |
| C. | 阳极电极反应为:2C6H13COO--2e-=C12H26+2CO2↑ | |
| D. | 反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的△S>0 | |
| B. | 该反应的△H<0 | |
| C. | 该反应的逆反应在一定条件下也能自发进行 | |
| D. | 该反应的熵变效应大于焓变效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b-a=n+m | B. | a-b=n-m | C. | 质子数Y>X | D. | 核电荷数Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;D所在族元素的氢化物中,稳定性最强的是(填化学式)H2O.
;D所在族元素的氢化物中,稳定性最强的是(填化学式)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂金做首饰不能用金属键理论解释 | |
| B. | 固态和熔融时易导电,熔点在1 000℃左右的晶体可能是金属晶体 | |
| C. | Li、Na、K的熔点逐渐升高 | |
| D. | 金属导电和熔融电解质(或电解质溶液)导电的原理一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com