
下列离子方程式书写正确的是( )
|
| A. | 碳酸氢钠的水解:HCO3﹣+H2O⇌H3O++CO32﹣ |
|
| B. | 以硫酸铝和小苏打为主要反应物的泡沫灭火器中的反应原理:Al3++3HCO3﹣═Al(OH)3↓+3CO2↑ |
|
| C. | 1 mol/L NH4Al(SO4)2溶液中逐滴加入等体积4 mol/L NaOH溶液:Al3++4OH﹣═AlO2﹣+2H2O |
|
| D. | 用惰性电极电解AlCl3溶液:2Cl﹣+2H2O |
| 离子方程式的书写. | |
| 专题: | 离子反应专题. |
| 分析: | A.碳酸氢根离子水解生成碳酸和氢氧根离子,溶液显示碱性; B.铝离子与碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体; C.铵根离子结合氢氧根离子能力大于氢氧化铝,氢氧化铝溶解前铵根离子先与氢氧根离子反应生成一水合氨; D.溶液中含有铝离子,铝离子与氢氧根离子反应生成氢氧化铝沉淀. |
| 解答: | 解:A.碳酸氢钠的水解生成碳酸和氢氧根离子,正确的离子方程式为:HCO3﹣+H2O⇌H2CO3+OH﹣,故A错误; B.以硫酸铝和小苏打为主要反应物的泡沫灭火器,铝离子与碳酸氢根离子之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为:Al3++3HCO3﹣═Al(OH)3↓+3CO2↑,故B正确; C.1 mol/L NH4Al(SO4)2溶液中逐滴加入等体积4 mol/L NaOH溶液,硫酸铝铵与氢氧化钠的物质的量之比为1:4,由于铵根离子结合氢氧根离子能力大于氢氧化铝,所以反应生成氢氧化铝沉淀和一水合氨,正确的离子方程式为:NH4++Al3++4OH﹣═Al(OH)3↓+NH3•H2O,故C错误; D.用惰性电极电解AlCl3溶液,反应生成氢氧化铝沉淀、氢气和氯气,正确的离子方程式为:2Al3++6Cl﹣+6H2O 故选B. |
| 点评: | 本题考查了离子方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等),选项C为易错点,注意反应生成氢氧化铝沉淀和一水合氨. |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
恒容密闭容器中进行的可逆反应2NO2  2NO +O2,可作为达到平衡状态的标志是
2NO +O2,可作为达到平衡状态的标志是
①单位时间内生成a mo1 O2的同时生成2a mol NO2 ;
②单位时间内生成a mol O2的同时生成2a molNO;
③混合气体的颜色不再改变;
④混合气体的密度不再改变的状态;
⑤混合气体的平均相对分子质量不再改变的状态。
A.①②③④⑤ B.②④⑤ C.①③④ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方程式正确的是( )
A.用铁丝网作电极,电解饱和食盐水:
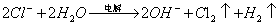
B.Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:
3Ba2++6OH-+2Al3++3SO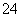 →3BaSO4↓+2Al(OH)3↓
→3BaSO4↓+2Al(OH)3↓
C.向H218O中投入Na2O2固体: 2H218O + 2Na2O2→ 4Na+ + 4OH-+ 18O2↑
D.石灰乳中Ca(OH)2的电离:Ca(OH)2(s) 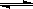 Ca2++ 2OH-
Ca2++ 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
某二元酸(化学式用H2A表示)在水溶液中的电离方程式是H2A===H++HA-;HA-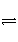

H++A2-。
回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)________________________________________________________________________。
(2)若0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能__________0.11 mol·L-1(填“>”、“=”或“<”),理由是
________________________________________________________________________
__________________。
(3)0.1 mol·L-1 NaHA的溶液中各种离子浓度由大到小的顺序是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中,不正确的是( )
|
| A. | a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN﹣),则a一定小于b |
|
| B. | 常温,CH3COONa溶液的pH=8,则c(Na+)﹣c(CH3COO﹣)=9.9×10﹣7mol/L |
|
| C. | 常温下,0.1mol/L的某酸溶液中,若c(OH﹣)/c(H+)=1×10﹣8,则溶液中由水电离出的c(H+)=1×10﹣11mol/L |
|
| D. | 在0.1mol/L的Na2SO3溶液中加入少量NaOH固体,c(SO32﹣)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸溶液中存在电离平衡:CH3COOH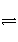
 H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.CH3COOH溶液中离子浓度的关系满足:[H+]=[OH-]+[CH3COO-]
B.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中[OH-]增大
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
一种澄清透明的溶液中,可能含有下列离子:K+、Fe3+、Ba2+、Al3+、NH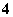 、Cl-、NO
、Cl-、NO 、HCO
、HCO 、SO
、SO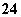 。现做以下实验:
。现做以下实验:
(1)将溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2)取少量溶液,加入用稀HNO3酸化的BaCl2溶液,产生白色沉淀;
(3)将(2)中的沉淀过滤,向滤液中加入AgNO3溶液,产生白色沉淀;
(4)另取溶液,逐滴加入NaOH溶液至过量,只看到有红褐色沉淀生成,且沉淀质量不减少。
由此可以推断:
溶液中肯定存在的离子有_________________________________________________;
溶液中肯定不存在的离子有________________________________________________;
溶液中不能确定是否存在的离子有_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A. 126C 、136C 、146C 为碳元素的三种核素。元素周期表中碳的相对原子质量为12.01,说明自然界中的碳主要以126C 的核素形式存在。146C为放射性核素,可用于同位素示踪
B.汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率
C.道尔顿、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识
D.地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油的成分与从石油中提取的柴油成分不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com