
【题目】下列物质属于电解质且能导电的是( )
A.金属铜
B.碳酸钠晶体
C.硝酸钠溶液
D.熔融氯化钠
科目:高中化学 来源: 题型:
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是 ( )
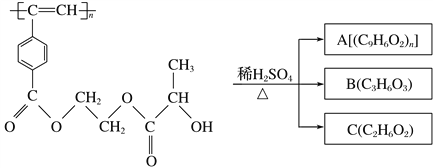
M
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. 1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D. A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸年产量的高低可衡量一个国家化工生产水平发展的高低,SO2转化为SO3是制备硫酸中的关键性反应,也是一个可逆反应。
(1)NO可作为SO2与O2间反应的催化剂,催化机理如下:
①2NO(g)+O2(g)![]() 2NO2(g)ΔH1=-113kJ/mol
2NO2(g)ΔH1=-113kJ/mol
②SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH2
SO3(g)+NO(g) ΔH2
总反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH3=-196.6kJ/mol ΔH2=__________
2SO3(g)ΔH3=-196.6kJ/mol ΔH2=__________
(2)一定温度下,向容积为2L的恒容密闭容器中充入2molSO2、2mo1O2测得容器中压强的变化如下表所示(SO3为气体):
反应时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/MPa | 16.0a | 14.7a | 13.7a | 13.0a | 12.5a | 12.4a | 12.4a |
①0~10min内,υ(SO2)=_________
②该温度下的平衡常数K=__(结果保留一位小数)。
③反应达到平衡后,再向容器中同时充入均为0.2mol的三种气体后,υ(正)、υ(逆)的关系是___
(3)一定温度下,向某密闭容器中通入一定量的二氧化硫和氧气的混合气体并使之反应,反应过程中SO2、O2、SO3物质的量变化如下图所示:
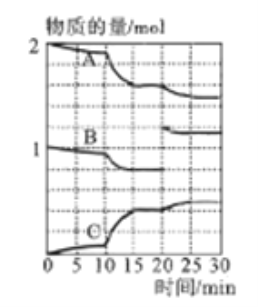
①A、B、C三条曲线中表示SO2物质的量的变化的是__,若在15~20min、25~30min两个时间段内容器容积不变,则在某一时刻SO3的分解速率较大的时间段是_______。
②10~15min内反应速率发生了明显变化,其可以的原因有__________
(4)常温下,用NaOH溶液吸收SO2既可消除SO2造成的大气污染,也可获得重要的化工产品,若某吸收液中c(HSO3-):c(SO32-)=1:100,则所得溶液的pH=______(常温下K1(H2SO3)=1.5×10-2、K2(H2SO3)=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
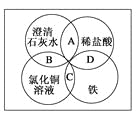
A. OH-+HCl===H2O+Cl-
B. Ca(OH)2+Cu2+===Ca2++Cu(OH)2
C. Fe+Cu2+===Cu+Fe2+
D. Fe+2H+===Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2用作橡胶的低温硫化剂和粘结剂,向熔融的硫中通入限量氯气反应制得,进一步氯化可得SCl2。S2Cl2、SCl2的某些性质如下:
水溶性 | 密度(g/cm3) | 颜色 | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,遇水即水解 | 1.687 | 金黄色 | -76℃ | 138℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | 樱桃红 | -122℃ | 59℃ |
用如图所示装置制备S2Cl2,回答下列问题:
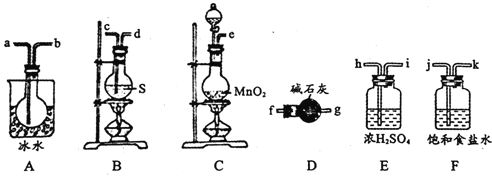
(1)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式为________。
(2)制取Cl2应选用的裝置是_______(填字母编号);反应的离子方程式为________。
(3)欲得到较纯净的S2Cl2,上述仪器装置的连接顺序为____(按气流方向,用小写字母表示)。
(4)仪器D的名称是_______;D中碱石灰的作用是________。
(5)为了获得更纯净的S2Cl2,需要对产品进行的操作是____________
(6)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的化学方程式_________;该反应中被氧化和被还原的元素的质量之比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出方程式:
(1)铁和水蒸气反应(写出化学方程式)__________________________________________
(2)氢氧化钡溶液和少量硫酸氢钠溶液混合(写出离子方程式)__________________________________
(3)Fe2(SO4)3溶于水(写出电离方程式) _________________________
(4)CO32— +2H+=CO2↑+H2O(写出对应的一个化学方程式)___________________
(5)铝和氢氧化钠溶液反应(写出离子方程式)_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁及其化合物在生活、生产中有广泛的应用。请回答下列问题:
①黄铁矿(FeS2,二硫化亚铁)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为_____,若有3mol FeS2参加反应,转移__________mol电子。
②FeCl3与氢碘酸反应时可生成棕色物质I2,该反应的离子方程式为_________________。
(2)对反应NH3+O2—NO+H2O(未配平,反应条件略去)作分析,该反应中,还原剂是_______,还原产物是________,被还原的物质是_________。参加反应的氧化剂为3.2g时,反应转移的电子的物质的量为________________。
(3)对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO![]() ,同时生成NH3,该反应的离子方程式为____________(提示:反应过程中N元素化合价不发生改变)。
,同时生成NH3,该反应的离子方程式为____________(提示:反应过程中N元素化合价不发生改变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com