
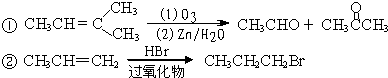
| 2×8+2-8 |
| 2 |
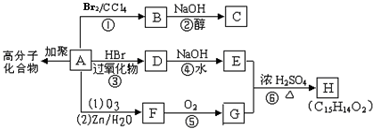
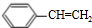 ,A发生加聚反应生成高分子化合物为
,A发生加聚反应生成高分子化合物为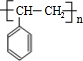 .A与溴发生加成反应生成B,B为
.A与溴发生加成反应生成B,B为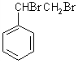 ,B在氢氧化钠醇溶液、加热条件下发生消去反应生成C,C为
,B在氢氧化钠醇溶液、加热条件下发生消去反应生成C,C为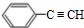 .A与HBr在过氧化物条件下发生加成反应生成D为
.A与HBr在过氧化物条件下发生加成反应生成D为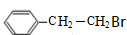 ,D在氢氧化钠水溶液、加热条件下发生水解反应生成E,则E为
,D在氢氧化钠水溶液、加热条件下发生水解反应生成E,则E为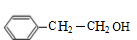 .A发生臭氧氧化生成F,F发生氧化反应生成G,G与E发生酯化反应生成H,结合H的分子式可知,F为
.A发生臭氧氧化生成F,F发生氧化反应生成G,G与E发生酯化反应生成H,结合H的分子式可知,F为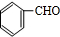 ,G为
,G为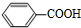 ,则H为
,则H为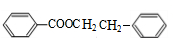 ,据此解答.
,据此解答.| 2×8+2-8 |
| 2 |
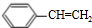 ,A发生加聚反应生成高分子化合物为
,A发生加聚反应生成高分子化合物为 .A与溴发生加成反应生成B,B为
.A与溴发生加成反应生成B,B为 ,B在氢氧化钠醇溶液、加热条件下发生消去反应生成C,则C为
,B在氢氧化钠醇溶液、加热条件下发生消去反应生成C,则C为 .A与HBr在过氧化物条件下发生加成反应生成D为
.A与HBr在过氧化物条件下发生加成反应生成D为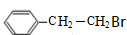 ,D在氢氧化钠水溶液、加热条件下发生水解反应生成E,则E为
,D在氢氧化钠水溶液、加热条件下发生水解反应生成E,则E为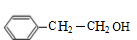 .A发生臭氧氧化生成F,F发生氧化反应生成G,G与E发生酯化反应生成H,结合H的分子式可知,F为
.A发生臭氧氧化生成F,F发生氧化反应生成G,G与E发生酯化反应生成H,结合H的分子式可知,F为 ,G为
,G为 ,则H为
,则H为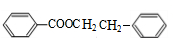 ,
,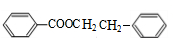 ,故答案为:
,故答案为: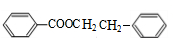 ;
;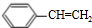 ,分子中存在苯环与碳碳双键形成的平面,两个平面可能共面,也可能不共面,分子中所有原子不一定共面;F为
,分子中存在苯环与碳碳双键形成的平面,两个平面可能共面,也可能不共面,分子中所有原子不一定共面;F为 ,G为
,G为 ,分子中存在的苯环平面与碳氧双键形成的平面,两个平面可能共面,也可能不共面,分子中所有原子不一定共面;
,分子中存在的苯环平面与碳氧双键形成的平面,两个平面可能共面,也可能不共面,分子中所有原子不一定共面; ,D为
,D为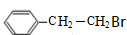 ,E为
,E为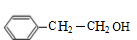 ,H为
,H为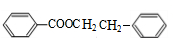 ,四分子中均存在甲烷的四面体结构,所有原子不可能处于同一平面内;
,四分子中均存在甲烷的四面体结构,所有原子不可能处于同一平面内; ,碳碳三键的直线结构处于苯的平面结构内,分子中的所有原子肯定在同一平面上,
,碳碳三键的直线结构处于苯的平面结构内,分子中的所有原子肯定在同一平面上, +2NaOH
+2NaOH| 醇 |
| △ |
 +2NaBr+2H2O,
+2NaBr+2H2O, +2NaOH
+2NaOH| 醇 |
| △ |
 +2NaBr+2H2O.
+2NaBr+2H2O.


科目:高中化学 来源: 题型:
| A、Ca(OH)2的溶解度、溶剂的质量 |
| B、溶液中溶质的质量分数 |
| C、溶液的质量、水的电离平衡 |
| D、溶液中Ca2+的数目、溶液中Ca2+的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡中加入稀硫酸:Ba2++OH-+SO42-+H+=BaSO4↓+H2O |
| B、氧化铜溶于稀硫酸:2H++CuO=Cu2++H2O |
| C、碳酸钙溶于盐酸:CO32-+2H+=CO2↑+H2O |
| D、铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一种纯净的化合物 |
| B、一种单质和一种化合物的混合物 |
| C、两种化合物的混合物 |
| D、两种单质的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
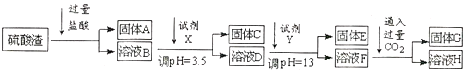
| 阳离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全时的pH | 3.2 | 5.2 | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2:2 |
| B、1:3:3 |
| C、2:3:6 |
| D、3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
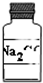 固体A的试剂瓶签已部分被腐蚀(如图所示).已知固体A只可能是Na2CO3、Na2SO3和Na2SO4中的一种.若取少量固体A配成稀溶液进行实验鉴定,下列说法错误的是( )
固体A的试剂瓶签已部分被腐蚀(如图所示).已知固体A只可能是Na2CO3、Na2SO3和Na2SO4中的一种.若取少量固体A配成稀溶液进行实验鉴定,下列说法错误的是( )| A、只用盐酸一种试剂就可以确定该固体A的成分 |
| B、依次加入Ba(NO3)2溶液、盐酸,若有白色沉淀,则固体A为Na2SO4 |
| C、滴入酸性KMnO4溶液,若KMnO4溶液褪色,则固体A为Na2SO3 |
| D、用pH试纸检验(常温),若pH>7,则固体A可能是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定无Na2CO3,可能有FeCl3 |
| B、可能有Na2CO3和NaCl |
| C、一定有MgCl2,可能有NaCl |
| D、一定有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com