
| A. | 原子核都是由质子和中子构成 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3是电解质 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 过量的铜与浓硝酸反应有NO生成 |
分析 A.原子核可能不含中子;
B.三氧化硫和水反应生成硫酸,硫酸电离出阴阳离子而使其溶液导电,三氧化硫是非电解质;
C.发生的反应为AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-;
D.过量的铜与浓硝酸混合时,先生成NO2后生成NO.
解答 解:A.原子核可能不含中子,如11H,故A错误;
B.三氧化硫和水反应生成硫酸,硫酸电离出阴阳离子而使其溶液导电,所以电离出阴阳离子的是硫酸而不是三氧化硫,则三氧化硫是非电解质,故B错误;
C.发生的反应为AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,所以没有气体生成,故C错误;
D.过量的铜与浓硝酸混合时,Cu和浓硫酸反应生成NO2,但硝酸浓度达到一定程度后,Cu和硝酸反应生成NO,故D正确;
故选D.
点评 本题考查原子结构、电解质和非电解质判断、硝酸的性质等知识点,侧重考查基本概念、物质性质,易错选项是CD,注意硝酸和Cu反应过程中浓度发生变化导致产生的气体发生变化.


科目:高中化学 来源: 题型:解答题

| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
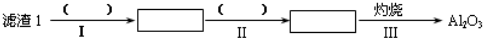
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中元素种类最多的周期是第6周期 | |
| B. | 第IA族元素均为碱金属元素 | |
| C. | 原子最外层电子数为2的元素一定位于第ⅡA族 | |
| D. | 元素周期表中元素种类最多的族是第Ⅷ族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
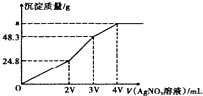 某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )| A. | 所加AgNO3溶液的物质的量浓度为$\frac{0.1}{V}mol•{L}^{-1}$ | |
| B. | a的数值为62.65 | |
| C. | 常温下,AgCl,AgI,AgS在水中溶解能力依次减小 | |
| D. | 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol | B. | 4mol | C. | 3mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4的沸点高于CH4,可推测PH3的沸点也高于NH3 | |
| B. | CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体 | |
| C. | PCl3 为三角锥形,可推测NF3也为三角锥形结构 | |
| D. | C2H6的碳链是直线型的,可推测C3H8的碳链也是直线型的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前5 s内,用NO表示的平均反应速率为0.1 mol•L-1•S-1 | |
| B. | 达到平衡后,CO2的浓度与CO的浓度不同 | |
| C. | 当v正(CO)=2v逆(N2)时反应达到平衡 | |
| D. | 达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ NH+4 Fe2+ Ba2+ Cu2+ |
| 阴离子 | OH- I- NO3- AlO2- HCO3- HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 元素对应的离子半径:Z>M>R>W | |
| B. | 简单氢化物的沸点:W>R>Y>X | |
| C. | M、N、R、W的简单离子均能促进水的电离 | |
| D. | Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com