
短周期元素X、Y、Z、W在元素周期表中的相对位置如右下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
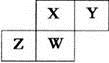
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:实验题
新切开的苹果在空气中放置一段时间表面会变黄,最终变成褐色,这种现象在食品科学上通常称为“褐变”。 关于苹果褐变的原因有以下两种说法:为____________
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究。
实验用品:苹果、浓度均为0.1mol·L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水。
(1)探究1:
实验操作 | 实验现象 | 结论 |
在“褐变”后的苹果上滴上2~3滴 溶液。 | _________________ | 说法A不正确 |
(2)探究2:【查阅文献】Ⅰ.苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5。Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色。
该小组将刚削皮的苹果切成七块,分别进行如下实验。请填写下表中相应的结论:
序号 | 实验步骤 | 现 象 |
|
① | 在一块上滴加2至3滴FeCl3溶液 | 表面变为绿色 | ______________ |
② | 再取两块,一块放置于空气中,另一块迅速浸入经过去氧的蒸馏水中。 | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化。 | 苹果褐变与_________有关 |
③ | 另两块分别立刻放入沸水和0.1mol·L–1盐酸中浸 | 相当长一段时间内,两块均无明显变化。 | 苹果褐变与酚氧化酶的活性有关 |
④ | 最后两块分别立刻放入浓度均为0.1mol·L–1的NaHCO3和Na2SO3溶液里浸泡2min后取出,置于空气中。 | 前者经过一段时间表面逐渐褐变,后者相当长一段时间内,无明显变化。 | 亚硫酸钠溶液能阻止苹果褐变 |
(3)问题分析:Ⅰ、常温下,浓度均为0.1 mol· L-1 NaHC O3溶液略显碱性,而NaHSO3溶液却略显酸性。 NaHSO3溶液略显酸性是因为 。
O3溶液略显碱性,而NaHSO3溶液却略显酸性。 NaHSO3溶液略显酸性是因为 。
Ⅱ、0.1mol· L–1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因 : 。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:实验题
甲、乙两同学欲分别完成“钠与氯气反应”的实验。
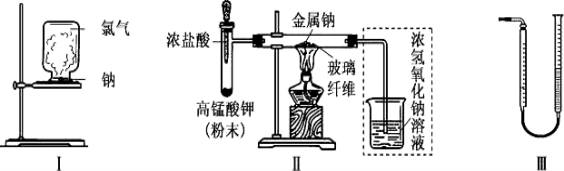
I.甲同学的方案为:取一块绿豆大的金属钠(除去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶抽去玻璃片后倒扣在钠的上方(装置如图工)。该方案的不足之处有 。
Ⅱ.乙同学所采用的装置如图Ⅱ,回答下列问题:
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为 ;待整套装置中 后,点燃酒精灯。
(2)点燃酒精灯后,玻璃管中出现的现象是__________________。
(3)乙同学欲将虚框内装置改为图III,所示装置,并测量多余气体的体积。
①为提高测量的准确性,图III,量气管装置中的液体可用 ;收集完气体后并读数,读数前应进行的操作是冷却至室温并 。
②若未冷却至室温立即按上述操作读数,则会导致所观测气体的体积 (填“偏大”“偏小”或“无影响”,下同)。
③如果开始读数时操作正确,最后读数时俯视右边量气管液面,会导致所测气体的体积 。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:选择题
某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是
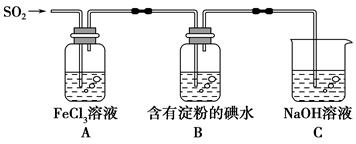
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液退色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色退去
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上11月月考化学卷(解析版) 题型:填空题
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。
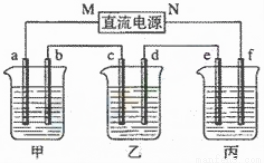
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
① 电源的N端为______________极;
② 电极b上发生的电极反应为_______________;
③ 列式计算电极b上生成的气体在标准状况下的体积_____________(保留小数点后一位);
④ 电极c的质量变化是____________g;
⑤ 电解前后各溶 液的PH变化(填“增大”、“减小”、“不变”),简述其原因:
液的PH变化(填“增大”、“减小”、“不变”),简述其原因:
甲溶液______________________;
乙溶液______________________;
丙溶液______________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上模拟四化学卷(解析版) 题型:填空题
【化学-物质结构与性质】
配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)写出元素D在周期表中的位置是 ,B原子的外围电子排布图 。E原子的核外有 种不同运动状态的电子,B和C的第一电离能大小关系 。(用元素符号表示)
(2)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,画出原子个数比为1:1的化合物的电子式 ,两种化合物可任意比互溶,解释其主要原因为 。
(3)该配位化合物的化学式为 。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 。
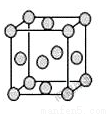
(5)已知E的晶胞结构如图所示,此晶胞立方体的边长为a cm,E单质的密度为pg.cm-3,则阿伏伽德罗常数为 (用a、p表示)。该晶胞配位数为 ,EDC4常作电镀液,其中DC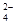 的空间构型是 ,其中D原子的杂化轨道类型是 。若电解EDC4的水溶液,则电解总反应的化学方程式为 。
的空间构型是 ,其中D原子的杂化轨道类型是 。若电解EDC4的水溶液,则电解总反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上模拟四化学卷(解析版) 题型:选择题
下列叙述中,正确的是( )
A.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
B.在加入铝粉能放出氢气的溶液中:K+、NH4+、NO3-、Cl- 一定能够大量共存
C.利用食醋除去热水瓶水垢中CaCO3的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O
D.除去乙酸乙酯中的少量乙酸:加入过量的NaOH溶液,静置分层后,除去水层
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
下列实验过程始终无明显现象的是
A. CO2气体通入Ba(NO3)2溶液中 B. NO2气体通入FeSO4溶液中
C. H2S气体通入CuSO4溶液中 D. HCl气体通入NaSiO3溶液中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
已知25℃时一些难溶物质的溶度积常数如下:
化学式 | Zn(OH)2 | ZnS | AgCl | Ag2S | MgCO3 | Mg(OH)2 |
溶度积 | 5×10-17 | 2.5×10-22 | 1.8×10-10 | 6.3×10-50 | 6.8×10-6 | 1.8×10-11 |
根据上表数据,判断下列化学方程式不正确的是
A.2AgCl+Na2S═2NaCl+Ag2S
B.MgCO3+H2O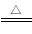 Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
C.ZnS+2H2O═Zn(OH)2+H2S↑
D.Mg(HCO3)2+2Ca(OH)2═Mg(OH)2↓+2CaCO3↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com