
分析 三种短周期元素X、Y、Z,它们的原子序数之和为16,X、Y、Z三种元素的常见单质在常温下都是无色气体,这三种单质气体是氢气、氮气和氧气,X原子的最外层电子数是内层电子数的3倍,最外层电子数不超过8个,其内层为K层,则X是O元素,X和Z的单质直接化合形成液态化合物B,则B是H2O,Z是H元素,所以Y是N元素,X和Y的单质直接化合形成气体A是NO,氮气和氢气直接化合形成的化合物C是一种无色有刺激性气味的气体C是NH3.
解答 解:三种短周期元素X、Y、Z,它们的原子序数之和为16,X、Y、Z三种元素的常见单质在常温下都是无色气体,这三种单质气体是氢气、氮气和氧气,X原子的最外层电子数是内层电子数的3倍,最外层电子数不超过8个,其内层为K层,则X是O元素,X和Z的单质直接化合形成液态化合物B,则B是H2O,Z是H元素,所以Y是N元素,X和Y的单质直接化合形成气体A是NO,氮气和氢气直接化合形成的化合物C是一种无色有刺激性气味的气体C是NH3.
(1)Y是N元素,N原子核外有2个电子层、最外层电子数是5,所以N元素位于第二周期第VA族,故答案为:第二周期第VA族;
(2)NH3和O2在催化剂、加热条件下反应生成NO和水,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+4H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+4H2O;
(3)已知:①Y2(g)+2X2(g)═2YX2(g)△H=+67.7kJ•mol-1,
②Y2Z4(g)+X2(g)═Y2(g)+2Z2X(g)△H=-534kJ•mol-1,
根据盖斯定律,2×②-①可得:2Y2Z4(g)+2YX2(g)═3Y2(g)+4Z2X(g)△H=2×(-534kJ•mol-1)-(+67.7kJ•mol-1)=-1135.7kJ/mol,
故答案为:-1135.7.
点评 本题考查元素化合物推断、反应热有关计算等,掌握根据盖斯定律计算反应反应热,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 核裂变是一种化学变化 | |
| B. | 12753I的质量数为127,原子序数为53,核内有74个中子 | |
| C. | 碘12753I和放射性碘13153I属于同素异形体 | |
| D. | 12753I与13153I是同一种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的电流方向是由锌到二氧化猛 | |
| B. | 该电池反应中MnO2起催化作用 | |
| C. | 当0.1molZn完全溶解时,流经电解液的电子个数为1.204×1023 | |
| D. | 电池正极反应为2MnO2+e-+2H2O=2MnO(OH)+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
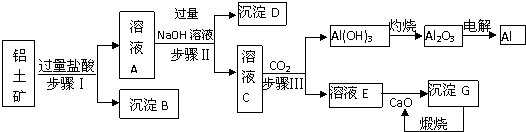
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
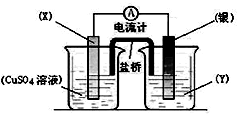
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com