
分析 (1)向集满CO2的铝罐中加入过量氢氧化钠,首先CO2与氢氧化钠反应,发生反应为:CO2+2OH-=CO32-+H2O,表现为铝罐变瘪;接着过量的氢氧化钠再与铝罐反应生成氢气,发生反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑,则罐壁又重新凸起;因铝罐表面有氧化膜Al2O3,则又能够发生反应:Al2O3+2OH-=2AlO2-+H2O,据此进行解答;
(2)镁与四氯化钛发生置换反应生成单质钛和氯化镁;在Ar气氛中进行的理由是防止镁被氧化;
(3)根据质量守恒配平如下:2Mg5Al3(OH)19(H2O)4$\frac{\underline{\;\;△\;\;}}{\;}$27H2O↑+10MgO+3Al2O3 ,
①分解反应是吸热反应且生成的氧化镁、氧化铝的熔点高;
②氧化镁是碱性氧化物,氧化铝是两性氧化物,依据二者性质不同除去.
解答 解:(1)向集满CO2的铝罐中加入过量氢氧化钠,首先CO2与氢氧化钠反应,发生反应为:CO2+2OH-=CO32-+H2O,表现为铝罐变瘪;
接着过量的氢氧化钠再与铝罐反应生成氢气,发生反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑,则罐壁又重新凸起;
因铝罐表面有氧化膜Al2O3,则又能够发生反应:Al2O3+2OH-=2AlO2-+H2O,故答案为:CO2+2OH-=CO32-+H2O;2Al+2H2O+2OH-=2AlO2-+3H2↑;
(2)镁与四氯化钛发生置换反应生成单质钛和氯化镁,反应方程式为:2Mg+TiCl4 $\frac{\underline{\;高温\;}}{Ar}$2MgCl2+Ti;在Ar气氛中进行的理由是防止镁被氧化,故答案为:2Mg+TiCl4 $\frac{\underline{\;高温\;}}{Ar}$2MgCl2+Ti;防止Mg被氧化;
(3)根据质量守恒配平如下:2Mg5Al3(OH)19(H2O)4$\frac{\underline{\;\;△\;\;}}{\;}$27H2O↑+10MgO+3Al2O3 ,故答案为:2;10;3;27H2O;
①分解反应是吸热反应,降低温度,生成的氧化镁和氧化铝都是熔点很高的氧化物,附着表面会阻止燃烧,水蒸气稀释空气.
故答案为:反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气;
②氧化镁是碱性氧化物溶于酸,氧化铝是两性氧化物溶于酸、溶于碱,加入氢氧化钠溶解后过滤除去,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查了镁铝化合物性质,盐类水解的原理应用,主要是氧化镁、氧化铝性质的熟练掌握,题目难度不大.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
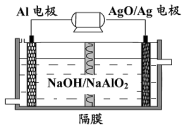 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.电池反应为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O下列说法中错误的是( )
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.电池反应为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O下列说法中错误的是( )| A. | 该装置可实现化学能向电能的转化 | B. | 电池工作时AgO得到电子 | ||
| C. | Al是负极 | D. | OH-透过隔膜向AgO/Ag极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向白醋中加入镁粉出现气泡 | B. | 用pH试纸测试其pH约为2 | ||
| C. | 用白醋做导电性实验,灯泡发亮 | D. | 向Cu(OH)2中加入白醋,Cu(OH)2溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、SO2、SO3均属于酸性氧化物 | |
| B. | H2SiO3、H2SO3、H2SO4均属于强酸 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、胶体和浊液 | |
| D. | 根据是否能导电,将物质分为电解质和非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过浓硫酸除去SO2中的H2O | B. | 通过灼热的CuO除去H2中的CO | ||
| C. | 通过灼热的镁粉除去N2中的O2 | D. | 通过碱石灰除去O2中的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2013年11月山东现“夺命快递”--化学品泄漏致1死7中毒.该化学品为氟乙酸甲酯,它是一种无色透明液体,不溶于水,易溶于乙醇、乙醚.它属于酯类,也属于卤代烃 | |
| B. | 酸性高锰酸钾溶液既可以用来鉴别甲烷和乙烯,也可以用来除去甲烷中的乙烯 | |
| C. | 已烷可以使溴水褪色是因为发生了取代反应 | |
| D. | 某种醇在适当条件下与足量的乙酸发生酯化反应,生成的酯的相对分子质量a与原来醇的相对分子量b的关系是a=b+84,则该醇分子中具有两个醇羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
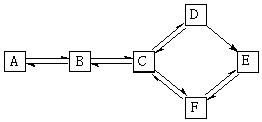 有A、B、C、D、E、F六种有机化合物,存在下图所示转化关系.已知A属于烃,且相对分子质量不超过30;在加热条件下,B可与氢氧化钠溶液反应,向反应后所得液中加入过量的硝酸,再加入硝酸银溶液,生成淡黄色沉淀.
有A、B、C、D、E、F六种有机化合物,存在下图所示转化关系.已知A属于烃,且相对分子质量不超过30;在加热条件下,B可与氢氧化钠溶液反应,向反应后所得液中加入过量的硝酸,再加入硝酸银溶液,生成淡黄色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨和硝酸都是重要的工业原料.
氨和硝酸都是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氯苯 | 邻二氯苯 | 对二氯苯 | |
| 沸点/℃ | 132.2 | 180.5 | 174 |
| 熔点/℃ | -45.6 | -15 | 53 |
| A. | 该反应属于取代反应 | |
| B. | 反应放出的氯化氢可以用水吸收 | |
| C. | 用蒸馏的方法可将邻二氯苯从有机混合物中首先分离出来 | |
| D. | 从上述两种二氯苯混合物中,用冷却结晶的方法可将对二氯苯分离出来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com