
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HBr→CH3CH2Br | ||
| C. |  +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$ +H2O +H2O | D. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O |
分析 A.甲烷中H被Cl取代;
B.碳碳双键转化为单键;
C.苯中H被硝基取代;
D.为燃烧反应.
解答 解:A.CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl为烷烃的取代反应,故A不选;
B.CH2=CH2+HBr→CH3CH2Br为烯烃的加成反应,故B选;
C. +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O为苯的取代反应,故C不选;
+H2O为苯的取代反应,故C不选;
D.CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O为氧化反应,故D不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应类型的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①②⑤ | C. | ②④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
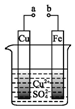
| A. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu | |
| B. | a和b不连接时,铁片上会有红色铜析出 | |
| C. | a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
 (标出配位键).
(标出配位键).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石比石墨稳定 | |
| B. | 1g石墨完全燃烧放出的热量比1g金刚石完全燃烧放出的热量多 | |
| C. | 能量低的状态更稳定,所以自然界的物质都以能量最低的形态存在 | |
| D. | 等质量的石墨和金刚石中所含原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| B. | 等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多 | |
| C. | 已知中和热为57.3 kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-Q1 kJ/mol 2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol,则Q1>Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6 L 氟化氢中含有氟原子的数目为 1.5NA | |
| B. | 常温常压下,7.0 g 乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 50mL l8.4 mol/L 浓硫酸与足量铜微热反应,生成 SO2分子的数目为 0.46NA | |
| D. | 某密闭容器盛有0.lmolN2和0.3molH2,在一定条件下充分反应,转移电子的数 目为 0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com