
 元素周期表可以指导我们寻找和合成成新的物质,如金属和非金属分界线附近的元素可用于制造半导体材料,是科学研究的热点
元素周期表可以指导我们寻找和合成成新的物质,如金属和非金属分界线附近的元素可用于制造半导体材料,是科学研究的热点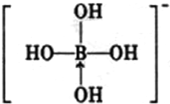 或
或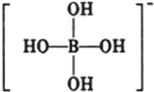 ,硼酸具有层状结构,每层结构如图所示,每摩尔晶体中所含氢键的数目为3NA(设NA为阿伏伽德罗常数的值)
,硼酸具有层状结构,每层结构如图所示,每摩尔晶体中所含氢键的数目为3NA(设NA为阿伏伽德罗常数的值) 分析 (1)锗为32号元素,根据构造原理书,基态锗原子核外电子排布式,然后确定价层电子排布图;
(2)根据反应物、生成物结合反应条件可书写化学方程式;金刚石中每个碳原子形成4个C-C键,所以C原子的杂化方式为sp3,原子和原子之间以共价键相结合,利用结构相似来解答;
(3)同一周期元素的第一电离能随着原子序数的增大呈增大趋势,注意第ⅤA族的大于第ⅥA族;晶体具有自范性、各向异性和固定的熔沸点;但晶体具有各向异性,多晶体和非晶体具有各向同性;合金中肯定含有金属元素;
(4)根据题目中的信息硼酸与水作用时,硼原子与水电离产生的OH-以配位键结合形成Y-离子来解答;由结构可知,一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子.
解答 解:(1)锗为32号元素,根据构造原理书,基态锗原子核外电子排布式:1s22s22p63s23p63d104s24p2,价层电子排布图为:4s24p2;
故答案为:4s24p2;
(2)反应物(CH3)3Ga和AsH3,生成物GaAs,根据质量守恒可知还应有CH4,反应的化学方程式为:(CH3)3Ga+AsH3$\frac{\underline{\;700℃\;}}{\;}$3CH4+GaAs;金刚石中每个碳原子形成4个C-C键,所以C原子的杂化方式为sp3,原子和原子之间以共价键相结合,而CaAs晶体结构与金刚石相似,晶体中Ca的杂化轨道类型为sp3,As与Ca之间存在的化学键有共价键;
故答案为:(CH3)3Ga+AsH3$\frac{\underline{\;700℃\;}}{\;}$3CH4+GaAs;sp3;共价键;
(3)同一周期元素的第一电离能随着原子序数的增大呈增大趋势,注意第ⅤA族的大于第ⅥA族,则元素As和Se中第一电离能较小的是Se;As2Se2是一种非晶态物质,所以不具有良好的自范性,不是合金,但具有各向同性;
故答案为:硒;B;
(4)硼酸与水作用,B(OH)3+H20? +H+;一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,则1个H3BO3分子的晶体中有6×$\frac{1}{2}$=3个氢键,因此含有1molH3BO3分子的晶体中有3mol氢键;
+H+;一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,则1个H3BO3分子的晶体中有6×$\frac{1}{2}$=3个氢键,因此含有1molH3BO3分子的晶体中有3mol氢键;
故答案为: 或
或 ;3NA.
;3NA.
点评 本题考查原子杂化、第一电离能、氢键的判断、原子核外电子排布等知识点,注重原子结构和性质的考查,难点是(4),注意每个分子形成氢键的个数.


科目:高中化学 来源: 题型:选择题
| A. | 碘乙烷水解实验后,取水解液,加入AgNO3溶液,检验卤素离子 | |
| B. | 碘乙烷水解实验后,取水解液,加入KMnO4(H+)溶液,检验产物乙醇 | |
| C. | 碘乙烷消去实验后,将气体导入KMnO4(H+)溶液,检验产物乙烯 | |
| D. | 碘乙烷消去实验后,将气体导入Br2(CCl4)溶液,检验产物乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 8种 | C. | 12种 | D. | 16种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{125a}{9V}$mol/L | B. | $\frac{125a}{18V}$mol/L | C. | $\frac{125a}{36V}$mol/L | D. | $\frac{125a}{54V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
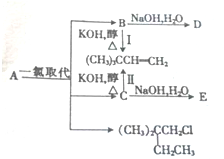 (1)A的分子式为C6H14,1molA完全燃烧消耗O29.5mol.
(1)A的分子式为C6H14,1molA完全燃烧消耗O29.5mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
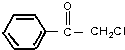
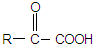
 .
.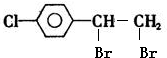 +2NaOH $→_{△}^{水}$
+2NaOH $→_{△}^{水}$ +2NaBr.
+2NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
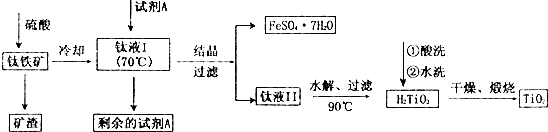
| A. | 过滤 | B. | 蒸发浓缩冷却结晶过滤 | ||
| C. | 水洗 | D. | 灼烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com