
| A. | 称量0.40g NaOH固体,在烧杯中加入100mL 水溶解即可 | |
| B. | 将称量好的固体NaOH放入100 mL容量瓶中,加蒸馏水溶解至环形刻线 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 将烧杯中溶解固体NaOH所得溶液冷却到室温后,转移至容量瓶中 |
分析 A、烧杯不能精确配制一定物质的量浓度的溶液,只能粗略配制溶液;
B、容量瓶不能溶解固体;
C、定容时如果加水超过了刻度线,只能重新配制,用胶头滴管直接吸出多余部分会导致浓度偏低;
D、氢氧化钠溶解后会放出热量,必须冷却后才能转移到容量瓶中.
解答 解:A、烧杯不能精确配制一定物质的量浓度的溶液,只能粗略配制溶液,故A错误;
B、容量瓶不能溶解固体,故B错误;
C、定容时如果加水超过了刻度线,只能重新配制,用胶头滴管直接吸出多余部分会导致浓度偏低;
D、氢氧化钠溶解后会放出热量,必须冷却到室温后才能转移到容量瓶中,否则导致配制的溶液体积偏小,物质的量浓度偏高,故D正确,
故选:D.
点评 本题考查了配制一定物质的量浓度的溶液的基本操作判断,题目难度不大,注意掌握配制一定物质的量浓度的溶液的步骤及正确操作方法,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
隐形眼镜越来越受到年青人的喜爱,在使用隐形眼镜时,常用的护理药水中含有过氧化氢(H2O2).下列有关过氧化氢的说法中正确的是
A.过氧化氢是由氢气和氧气组成的
B.它是由2个氢元素和2个氧元素组成的
C.过氧化氢在二氧化锰作用下能生成水和氧气,该反应为复分解反应
D.每个过氧化氢分子中含有2个氢原子和2个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 1.58 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
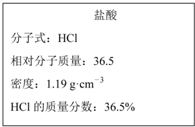 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
VL Fe2(S O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
A.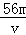 mol/L B.
mol/L B.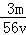 mol/L C.
mol/L C.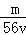 mol/L D.
mol/L D. mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 室温下向10mL 0.1mol•L-1 NaOH溶液中逐滴加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.
室温下向10mL 0.1mol•L-1 NaOH溶液中逐滴加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 消耗盐酸的体积/mL | 待测KOH溶液的体积/mL |
| 1 | 27.23 | 25.00 |
| 2 | 28.24 | 25.00 |
| 3 | 27.25 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10mL 1 mol•L-1 CH3COOH溶液需要10 mL 1 mol•L-1 NaOH溶液 | |
| B. | 物质的量浓度相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快 | |
| C. | 0.01mol•L-1醋酸溶液的pH大于2 | |
| D. | 0.1mol•L-1 CH3COONa溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
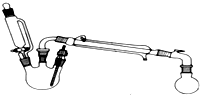 某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com