
【题目】正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:
2CH3CH2CH2CH2OH ![]() CH3CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2OCH2CH2CH2CH3+H2O
实验过程如下:在容积为100mL 的三颈烧瓶中将5mL浓硫酸、14.8g正丁醇和几粒沸石混合均匀,再加热回流一段时间,收集到粗产品,精制得到正丁醚.
回答下列问题: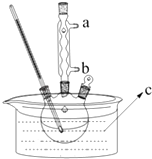
(1)合成粗产品时,液体试剂加入顺序是 .
(2)实验中冷凝水应从口出去(填“a”或“b”).
(3)为保证反应温度恒定在135℃,装置C中所盛液体必须具有的物理性质为 .
(4)得到的正丁醚粗产品依次用8mL50%的硫酸、10mL水萃取洗涤.该步骤中需要的属于硅酸盐材质的实验仪器是烧杯、玻璃棒、 , 该仪器使用前需要 .
(5)将分离出的有机层用无水氯化钙干燥,过滤后再进行(填操作名称)精制得到正丁醚.
(6)本实验最终得到6.50g正丁醚,则正丁醚的产率是 .
【答案】
(1)先加正丁醇,后加浓硫酸
(2)a
(3)该液体沸点大于135℃
(4)分液漏斗;检验是否漏水
(5)蒸馏
(6)50.0%
【解析】解:(1)因浓硫酸密度大于正丁醇密度,浓硫酸与正丁醇混合时,先加正丁醇后加硫酸,防止浓硫酸稀释时放热,引起液体飞溅,所以液体试剂加入顺序是:先加正丁醇,后加浓硫酸,
所以答案是:先加正丁醇,后加浓硫酸;(2)用冷凝管冷凝时,为了充分冷却,冷凝水的流向与气体流向相反,则冷凝水从a口进入,所以答案是:a;(3)加热液体能达到的最高温度等于其沸点,则为保证反应温度恒定在135℃,装置C中所盛液体的沸点应该大于135℃,
所以答案是:该液体沸点大于135℃;(4)分离分层的液体用分液漏斗,该步骤中需要的属于硅酸盐材质的实验仪器是烧杯、玻璃棒、分液漏斗,带有玻璃塞的仪器使用前要检漏,则在使用分液漏斗时要先检验是否漏水;
所以答案是:分液漏斗;检验是否漏水;(5)将分离出的有机层用无水氯化钙干燥,混溶的液体采用蒸馏的方法分离,正丁醚沸点为142.4℃,易挥发,采用蒸馏的方法获得纯净的正丁醚,
所以答案是:蒸馏;(6)由
2CH3CH2CH2CH2OH |
| CH3CH2CH2CH2OCH2CH2CH2CH3 | +H2O | |
74×2 | 130 | |||
14.8g | mg |
则m= ![]() =13.0g,
=13.0g,
产率= ![]() ×100%=
×100%= ![]() ×100%=50.0%,
×100%=50.0%,
所以答案是:50.0%.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法正确的是( ) 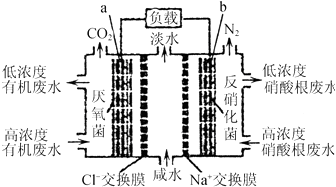
A.b电极上发生氧化反应
B.b电极附近溶液的pH增大
C.a电极反应式:C6H10O5+24e﹣+7H2O═6CO2↑+24H+
D.中间室:Na+移向左室,Cl﹣移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化不属于煤或石油的综合利用的是
A. 将煤干馏制得煤焦油和焦炭 B. 在一定条件下将煤与氢气转化为液体燃料
C. 将煤变为煤饼作燃料 D. 将石油裂解制得乙烯等化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 通过化学变化可以实现16O与18O间的相互转化
B. 离子化合物中的阳离子都是金属离子
C. 离子化合物中,一个阴离子可同时与多个阳离子之间有静电作用
D. 溶于水可以导电的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了三种制备方案:①用KI晶体与浓硫酸反应制HI ②用浓度均为0.1 mol·L-1的氯化铁和氢氧化钠混合制备氢氧化铁胶体 ③用纯碱和石灰水制烧碱,可用的方案是( )
A.①B.③
C.②③D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.焦炭在高温下与水蒸气的反应是吸热反应
B.氢氧化钾与硝酸的反应是放热反应
C.燃料有足够的空气就能充分燃烧
D.化学反应的过程,都可以看成是“贮存”在物质内部的能量转化为热能等而被释放出来的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题.
(1)含碳量在0.03%~2%之间某合金,是目前使用量最大的合金,这种合金是 .
A.铝合金
B.青铜
C.镁合金
D.钢
(2)FeCl3溶液用于腐蚀铜箔印刷线路板,反应的离子方程式为 .
(3)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是(填字母)
A.Mg2+
B.Fe2+
C.Al3+
D.Cu2+
(4)4Fe(NO3)2的高纯度结晶体是一种紫色潮解性固体,适合于制磁性氧化铁纳米粉末,工业上用废铁屑(含Fe和Fe2O3及其它不反应的物质)制取Fe(NO3)2晶体的方法如图: 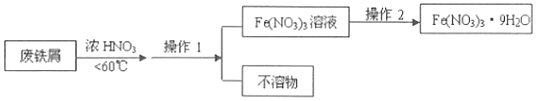 ①第1步反应若温度过高,将导致硝酸分解,浓硝酸受热分解的化学方程式为 .
①第1步反应若温度过高,将导致硝酸分解,浓硝酸受热分解的化学方程式为 .
②磁性氧化铁的化学式为 , 试写出Fe2O3与硝酸反应的离子方程式 .
③操作1的名称为 , 操作2的步骤为: , 过滤,洗涤.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题
(1)写出下列反应的离子方程式:MnO2+4HCl═MnCl2+Cl2↑+2H2O
(2)将离子方程式改写成化学方程式:2OH﹣+Mg2+═Mg(OH)2↓
(3)用双线桥表示电子转移情况,Fe2O3+3CO═2Fe+3C O2该反应的氧化产物是
(4)用单线桥表示电子转移情况 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O该反应的氧化剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在pH=11的某溶液中,由水电离的c(OH﹣)为( )
①1.0×10﹣7 molL﹣1 ②1.0×10﹣6 molL﹣1
③1.0×10﹣3 molL﹣1 ④1.0×10﹣11 molL﹣1 .
A.③
B.④
C.①或③
D.③或④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com