
下列实验操作与实验目的相符的是( )
| 序号 | 实验操作 | 实验目的 |
| A | 测定HF、HCl的熔点、沸点 | 比较F、Cl的非金属性强弱 |
| B | MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 | 比较镁、铝的金属性强弱 |
| C | 将SO2气体通入碳酸钠溶液中 | 比较碳、硫的非金属性强弱 |
| D | 向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量 | 比较NaOH、NH3·H2O、Al(OH)3的碱性强弱 |
科目:高中化学 来源: 题型:单选题
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g ? L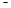 1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是( )
1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是( )
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由Y、Z、M三种元素形成的化合物一定只有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
| A.X2-的还原性一定大于Y- |
| B.由mXa+与nYb-得m+a=n-b |
| C.X、Y一定不是同周期元素 |
| D.若X的原子半径大于Y,则气态氢化物的稳定性一定是X大于Y |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为36,原子最外层电子数之和为14。其中A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。下列叙述正确的是
A.一定条件下,B单质能置换出D单质,C单质能置换出A单质
B.D元素处于元素周期表中第3周期第IVA族
C.A、C的最高价氧化物均为离子化合物
D.四种元素的原子半径:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 |
| B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素W、X、Y、Z的原子序数依次增大,下列相关比较错误的是
| A.稳定性:H2X H2Z | B.酸性:H2ZO3<H2ZO4 |
| C.还原性:W-<Z2- | D.半径:Y3+<Z2- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素的四种离子aW3+、bX+、cY2-、dZ- 它们的电子层结构相同,下列关系正确的是
| A.质子数c>d | B.离子的还原性Y2->Z- |
| C.氢化物的稳定性H2Y>HZ | D.原子半径X<W |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知33As、35Br位于同一周期,下列关系正确的是
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com