
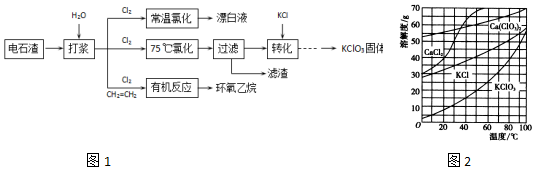
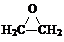 +CaCl2+H2O.
+CaCl2+H2O. 分析 电石渣主要含Ca(OH)2、CaCO3及少量其他杂质,加水打浆后,在常温下与氯气反应制备漂白液,反应的方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;75℃氯化生成氯酸钙,过滤除去不溶的CaCO3、Ca(OH)2,再加入KCl利用溶解度不同转化成氯酸钾;CH2=CH2和Cl2、H2O混合发生有机反应,首先生成氯代乙醇,再与Ca(OH)2反应生产环氧乙烷,据此分析解答.
解答 解:(1)①根据以上分析,Ca(OH)2在常温下与氯气反应制备漂白液,反应的方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
②A.加热升高温度,反应生成氯酸钙,则生成Ca(ClO)2的转化率降低,故A错误;
B.适当减缓通入Cl2速率,让Ca(OH)2充分反应,则可以提高生成Ca(ClO)2的转化率,故B正确;
C.充分搅拌浆料,让反应物充分反应,则可以提高生成Ca(ClO)2的转化率,故C正确;
D.加水使Ca(OH)2完全溶解,氢氧化钙浓度减小,则生成Ca(ClO)2的转化率降低,故D错误;
故选:BC;
③电石渣中的有害杂质CN-与ClO-反应转化为氯离子、二氧化碳和氮气,所以根据得失电子守恒,每转化1 mol CN-至少需要消耗氧化剂ClO- $\frac{(4-2)+(3-0)}{2}$=2.5mol,故答案为:2.5;
(2)①根据化合价代数和为0,则生成Ca(ClO3)2中氯的化合价为:+5价,氯化完成后过滤,CaCO3和过量的Ca(OH)2不溶,则滤渣的主要成分为CaCO3、Ca(OH)2,故答案为:+5价; CaCO3、Ca(OH)2;
②由溶解度曲线,75℃,氯酸钾的溶解度比氯酸钙、氯化钾、氯化钙都小得多,所以氯酸钙能与KCl反应转化为氯酸钾,故答案为:75℃,氯酸钾的溶解度比氯酸钙、氯化钾、氯化钙都小得多;
(3)CH2=CH2和Cl2、H2O混合发生有机反应,首先生成氯代乙醇,其结构简式为ClCH2CH2OH,氯代乙醇再与Ca(OH)2反应生产环氧乙烷.总反应的化学方程式是 CH2=CH2+Cl2+Ca(OH)2→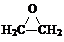
故答案为:ClCH2CH2OH; CH2=CH2+Cl2+Ca(OH)2→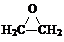
点评 本题综合考查了不同条件下反应产物的判断、化学方程式的书写,锻炼了学生的逻辑思维和分析解决问题的能力,难度不大.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
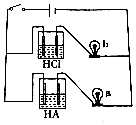
| A. | HA属于弱酸 | |
| B. | pH=1的HA溶液中由水电离出的c(H+)=10-13•L-1 | |
| C. | 等体积、等pH的HA和HCl溶液分别和NaOH溶液反应,HA消耗的NaOH较多 | |
| D. | 等体积的上述两种酸溶液分别和NaOH溶液反应,HA消耗的NaOH较少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
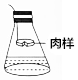 爱氏试剂(由质量分数为25%盐酸、96%乙醇与无水乙醚以体积之比为1:3:1配成的混合溶液)是工商部分用于检验猪肉(含N元素)是否变质(如图)的试剂,若观察到有白烟出现,则说明猪肉已变质.下列有关说法正确的是( )
爱氏试剂(由质量分数为25%盐酸、96%乙醇与无水乙醚以体积之比为1:3:1配成的混合溶液)是工商部分用于检验猪肉(含N元素)是否变质(如图)的试剂,若观察到有白烟出现,则说明猪肉已变质.下列有关说法正确的是( )| A. | 白烟的成分为NH4Cl | |
| B. | 可用稀硫酸代替盐酸 | |
| C. | 腐败肉样释放出的是N2 | |
| D. | 该检验可直接将肉样放入爱氏试剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
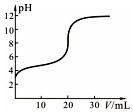 25℃时,用0.1000mol•L-1 KOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是( )
25℃时,用0.1000mol•L-1 KOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是( )| A. | V=0.00 mL时,CH3COOH溶液pH=3,其电离平衡常数K≈10-5mol•L-1 | |
| B. | V=10.00 mL时,溶液中c(CH3COO-)>c(K+)>c(H+)>c(OH-) | |
| C. | 溶液pH=7时,$\frac{c({K}^{+})•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$=1 | |
| D. | V≥20.00 mL时,溶液中c(K+)=c(CH3COO-)+c(OH-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
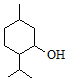
| A. | 薄荷醇分子式为C10H20O,它是环己醇的同系物 | |
| B. | 薄荷醇的分子中至少有12个原子处于同一平面上 | |
| C. | 薄荷醇在Cu或Ag做催化剂、加热条件下能被O2氧化为醛 | |
| D. | 在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的热稳定性:Y>Z | |
| B. | Y元素的氧化物对应的水化物一定是强酸 | |
| C. | M与R可形成含非极性键的化合物 | |
| D. | 固体X2Y3可在水溶液中制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯铜作阳极、粗铜作阴极 | |
| B. | 电解液的成分保持不变 | |
| C. | 屯解过程中,阳极质量的减少与阴明极质量的增加相等 | |
| D. | 阴极电极反应为:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com