
常温下,下列四种溶液:①1 mol·L-1的盐酸 ②0.1 mol·L-1的盐酸 ③0.01 mol·L-1的NaOH溶液 ④0.001 mol·L-1的NaOH溶液。四种溶液中,由水电离生成的[H+]之比为( )
A.1∶10∶100∶1 000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶1
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
下面三种方法均可制得Fe(OH)2白色沉淀。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
 (3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
(3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
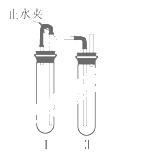
方法二:在如右图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试 管Ⅰ里加入的试剂是 。
管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得Fe(OH)2白色沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,
塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,
理由是 。
方法三:利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如右图所示,已知两电极的材料分别为石墨和铁。
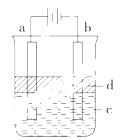 (1)a电极的
(1)a电极的 材料应为 ,电极反应式为 。
材料应为 ,电极反应式为 。
(2)电解液c可以是 (填编号)。
A.纯水 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是 ,在加入苯之前对电解液c
应作何简单处理? 。
(4)为了在较短时间内看到白色沉淀,可采取的措施是 (填编号)。
A.改用稀H2SO4作电解液 B.适当增大电源的电压
C.适当减小两极间的距离 D.适当降低电解液的温度
(5)若c用Na2SO4溶液,当电解一段时间后看到白色Fe(OH)2沉淀,再反接电源电解,除了电极上看到气泡外,另一明显现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和该性质的应用均正确的是
A.SO2具有氧化性,可用于漂白纸浆
B.炭具有还原性,一定条件下能将二氧化硅还原为硅
C.BaCO3、BaSO4都难溶于水,均可用做钡餐
D.Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e )化合物J由两种元素组成,其相对分子质量为32。
)化合物J由两种元素组成,其相对分子质量为32。
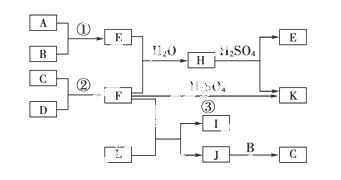
请按要求填空:
(1)反应③的化学方程式___________。
(2)C的结构式____________;H的化学式__________。
(3)L的溶液与化合物E反应的离子方程式_____________。
(4)化合物J的化学式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列不属于电离方程式的是( )
A.2H2O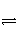
 H3O++OH-
H3O++OH-
B.H2O
 H++OH-
H++OH-
C.CH3COOH+H2O
 CH3COO-+H3O+
CH3COO-+H3O+
D.CH3COOH+NaOH===CH3COONa+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法正确的是( )
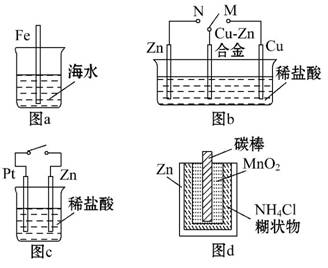
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(2)利用反应2Cu+O2+2H2SO4====2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 _____。
Ⅱ.(2012·福建高考)(1)电镀时,镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
Ⅲ.(2012·重庆高考)尿素[CO(NH2)2]是首个由无机物人工合成的有机物。人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图。
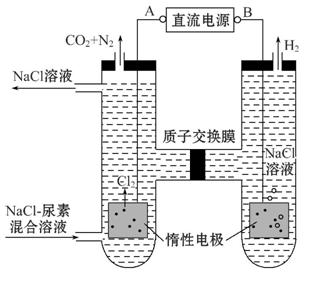
(1)电源的负极为 (填“A”或“B”)。
(2)阳极室中发生的反应依次为 、 。
(3)电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44 L(标准状况),则除去的尿素为 g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(l)===2NH3(g)+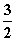 O2(g)
O2(g)
ΔH=765.2 kJ·mol-1
回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:
________________________________________________________________________
________________________________________________________________________。
(3)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为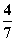 。计算:
。计算:
①该条件下N2的平衡转化率;
②该条件下反应2NH3(g)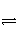
 N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:
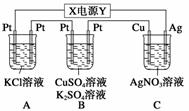
(1)电源中X极是__________(填“正”或“负”)极。
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前[CuSO4]=____________。
(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解后溶液的pH=
__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com