
【题目】如图是CO2催化还原为CH4示意图。下列说法不正确的是( )
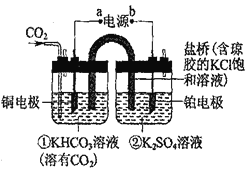
A.该过程是电能转化为化学能的过程
B.铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②池中溶液的pH一定下降
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,体积为5L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g) ![]() Z(g),经20s达到平衡,生成0.1molZ。下列说法正确的是( )
Z(g),经20s达到平衡,生成0.1molZ。下列说法正确的是( )
A.0~20s内,X的反应速率为0.01mol·L-1·s-1
B.将容器体积变为10L,Y的平衡浓度大于原来的![]()
C.其他条件不变,若增大压强,则该反应的平衡常数增大
D.若该反应的△H>0,升高温度,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列说法正确的是
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>b>c
B.KNO3溶液和CH3OOONH4溶液pH均为7,但两溶液中水的电离程度不相同
C.5.0×10-3 mol·L-1KHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A)
D.己知某分散系中存在:M(OH)2(s)![]() M2+(aq)+2OH-(aq),K=a,c(M2+)=b mol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq),K=a,c(M2+)=b mol·L-1时,溶液的pH等于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 反应CaCO3(s)===CaO(s)+CO2(g)在常温下不能自发进行,则该反应的ΔH<0
B. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
C. 不能用玻璃瓶来盛装氟化钠水溶液
D. 常温下Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体中硝酸盐造成的污染已成为突出的环境问题。某课题组研究了去除不同各种水体中NO3-的方法。
(1)用铝粉去除饮用水中NO3-的一种方案如下:

①用熟石灰而不用NaOH调节pH的主要原因是___。在调节pH时,若pH过大或过小都会造成Al的利用率降低。写出pH过大造成Al利用率降低的离子方程式___。
②在加入铝粉去除NO3-的反应中,氧化产物和还原产物的物质的量之比为___。
(2)用铁粉处理pH=2.5的含NO3-废水,测得溶液中相关离子浓度、pH随时间的变化关系如图(部分副反应产物略去):

①t1时刻前,该反应的离子方程式为___。
②研究表明:铁粉还原含NO3-废水时,加入活性碳粉可以提高去除NO3-的速率,可能的原因是___。
(3)用Pt作电极电解含NO3-的酸性废水,原理如图。N为电源的___(选填“正”或 “负”)极,与直流电源M端相连的Pt电极上的电极反应式为___。

(4)课题组以钛基氧化物涂层材料为惰性阳极、碳纳米管修饰的石墨为阴极,控制一定条件,电解含大量NO3-、SO42-的废水,可使NO3-变为NH4+。研究发现:其他条件不变,废水中加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低,可能的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水(过氧化氢)常用于消毒、杀菌、漂白等。某化学兴趣小组同学,围绕着过氧化氢开展了调査研究与实验。
I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是________。
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用如图表示,此过程中总反应式为________。
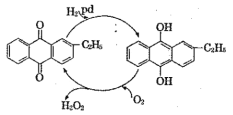
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
实验编号 | T/X | H2O2初始浓度/mol·L-1 | FeCl3初始浓度/mol·L-1 |
I | 20 | 1.0 | _______ |
II | 50 | 1.0 | 0 |
III | 50 | ___________ | 0.1 |
实验I、Ⅱ研究______对分解速率的影响,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为________mol·L-1。
III.过氧化氢含量的实验测定
兴趣小组同学用0.1000mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2+ +8H2O+5O2↑
(4)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为________mol·L-1(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐溶液NaHR的电离方程式为NaHR=Na++HR-下列有关说法不正确的是
A.Na2R溶液的pH值一定大于7
B.若NaHR溶液中c( OH-)>c( R2-)则溶液呈碱性
C.c(Na+)>c(HR-)>c( R2-)>c(OH-)>c( H+)
D.NaHR溶液的pH值不一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)![]() 2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L1
C.该反应的化学平衡常数可表示为K=![]()
D.升高温度,该反应的化学平衡常数减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com