
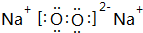
 ,含有离子键、共价键,
,含有离子键、共价键, ;离子键、共价键;
;离子键、共价键;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 某温度时,在一个5L的体积不变的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个5L的体积不变的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z三种元素,原子序数依次减小.X是第四周期主族元素,其部分电离能如图所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn.回答下列问题:
X、Y、Z三种元素,原子序数依次减小.X是第四周期主族元素,其部分电离能如图所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2OCH3 |
| B、CH3CH(OH)CH3 |
| C、CH3CH2OH |
| D、CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com