
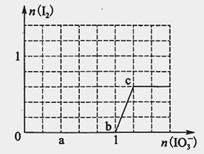
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
(1)写出a点反应的离子方程式________________;反应中还原剂是______________;被还原的元素是__。
(2)写出b点到c点反应的离子方程式_____________________________。
(3)若往100 mL 1 mol·L-1的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为__________。
【知识点】氧化还原反应原理的应用 离子方程式书写 B2 B3 B1
【答案解析】(1)3HSO +IO
+IO ===3SO
===3SO +I-+3H+ (2分)
+I-+3H+ (2分)
NaHSO3 (1分) 碘元素 (1分)
(2)5I-+IO +6H+===3I2+3H2O (2分)
+6H+===3I2+3H2O (2分)
(3)2IO +5HSO
+5HSO ===I2+5SO
===I2+5SO +3H++H2O(2分)
+3H++H2O(2分)
解析:根据还原性HSO-3>I-,向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,按照顺序先发生:2IO3-+6HSO3-═2I-+6SO42-+6H+,继续加入KIO3,由于氧化性IO-3>I2,再发生:IO3-+6H++5I-=3H2O+3I2,
(1)由图可知,a点没有生成碘,故发生反应2IO3-+6HSO3-═2I-+6SO42-+6H+,反应中S元素化合价升高,还原剂是HSO3-,I元素的化合价降低,I元素被还原;
(2)由图可知,b点到c点由于生成I2,故发生反应:IO3-+6H++5I-=3H2O+3I2;
(3)向100mL 1mol/L的KIO3溶液中滴加NaHSO3溶液,HSO3-被氧化为SO42-,KIO3过量,由于氧化性IO-3>I2,KIO3将氧化为I-,反应不能生成I-,而是生成I2,反应离子方程式为:2IO3-+5HSO3-=I2+5SO42-+3H++H2O。
【思路点拨】本题考查了氧化还原反应原理的应用,考查角度广,难度较大,理解氧化性及还原性顺序是关键。


科目:高中化学 来源: 题型:
已知X和Y是两种单质,X+Y→X2++Y2- ,现有下列叙述正确的是: ①X被氧化 ②X是氧化剂 ③Y2-是还原产物 ④X2+具有氧化性 ⑤Y2-具有还原性 ⑥Y单质氧化性比X2+氧化性强
A.①②③ B.①②⑥ C.①③④⑤⑥ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
将35.8 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44 LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
A. 66.4 g B.50.8 g C 44.8g D. 39.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
据最新报道,科学家发现了如下反应:O2+PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列叙述正确的是
A.在此反应中,每生成1molO2(PtF6),则转移1mol电子
B.在此反应中,O2是氧化剂,PtF6是还原剂
C.O2(PtF6)中氧元素的化合价是+1价
D.O2(PtF6)中仅存在离子键不存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中提取碘,可经过以下实验步骤完成,下列有关说法正确的是

A.在灼烧过程中使用的仪器有酒精灯、三脚架、泥三角、烧杯、玻璃棒
B.在上述氧化过程中发生的离子方程式为:2I-+H2O2 = I2 + 2OH-
C.在提取碘单质时,用酒精作萃取剂
D.在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
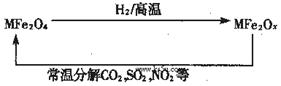
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为 2︰1,则还原产物 MFe2Ox 中x=______,MFe2Ox 中+2价铁与+3价铁的量之比为_____。
(2)在酸性溶液中,Fe2O42-易转化为Fe2+:Fe2O42-+2e-+8H+→2Fe2++4H2O有 KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com