
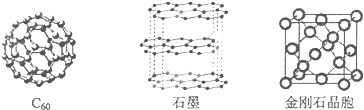
分析 (1)由同种元素组成的不同单质互称同素异形体;
(2)根据价层电子对互称理论确定原子杂化类型;
(3)分子晶体的构成微粒是分子,原子晶体的构成微粒是原子;
(4)共价单键为σ键,共价双键中含有σ键和π键;
(5)金刚石晶胞中碳原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$;根据硬球接触模型,正方体对角线的$\frac{1}{4}$就是C-C键的键长,据此计算原子半径.
解答 解:(1)由同种元素组成的不同单质互称同素异形体,这几种物质都是碳元素的不同单质,属于同素异形体,故答案为:同素异形体;
(2)金刚石中每个碳原子价层电子对个数是4,所以C原子杂化方式为sp3,石墨烯中每个碳原子价层电子对个数是3,所以碳原子杂化方式为sp2,
故答案为:sp3;sp2;
(3)C60的构成微粒是分子,所以属于分子晶体;石墨的构成微粒是原子,且层与层之间存在分子间作用力,所以石墨属于混合型晶体,
故答案为:分子;混合;
(4)共价单键为σ键,共价双键中含有σ键和π键,金刚石中碳原子之间只存在σ键,石墨中碳原子之间存在
σ键和π键,
故答案为:σ;σ和π;
(5)金刚石晶胞中碳原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8;根据硬球接触模型,正方体对角线的$\frac{1}{4}$就是C-C键的键长,晶胞正方体对角线长度=$\sqrt{3}$a,所以$\frac{1}{4}$$\sqrt{3}$a=2r,所以r=$\frac{\sqrt{3}}{8}$a,
故答案为:$\frac{\sqrt{3}}{8}$.
点评 本题考查晶胞计算、原子杂化、晶体类型判断等知识点,侧重考查分析判断及计算能力,难点是晶胞计算,明确金刚石中C-C键键长与棱长关系是解(4)题关键,题目难度中等.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | 提高了原料利用率 | B. | 降低了生产成本 | ||
| C. | 减少了环境污染 | D. | 减轻了对设备的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,1个O22+中含有2个π键.
,1个O22+中含有2个π键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y和Q可形成一种化合物Y2Q3 | |
| B. | T有一种单质的空间型为正四面体形 | |
| C. | X和Q结合生成的化合物为离子化合物 | |
| D. | ZO2是极性键构成的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
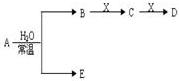 已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去).
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
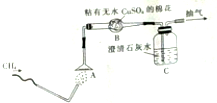 为了验证甲烷的燃烧产物,某同学设计了甲烷的燃烧实验(如图所示):
为了验证甲烷的燃烧产物,某同学设计了甲烷的燃烧实验(如图所示):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
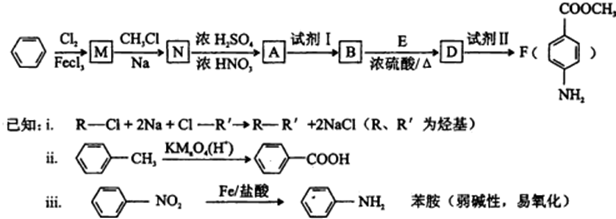
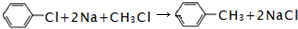 .
.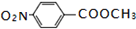 .
. ;
;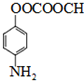 .
.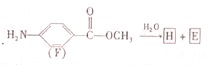
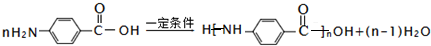 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
 .
.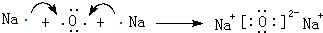 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com