
| A. | 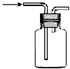 收集氢气 | B. | 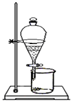 分离碘和泥沙 | ||
| C. | 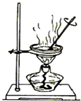 分离水和四氯化碳 | D. | 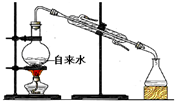 实验室制取蒸馏水 |
分析 A.氢气的密度比空气的密度小,利用向下排空气法收集;
B.泥沙不溶于水,碘易升华;
C.水和四氯化碳分层;
D.自来水中水的沸点低.
解答 解:A.氢气的密度比空气的密度小,利用向下排空气法收集,图中气体应从短导管进入,故A错误;
B.泥沙不溶于水,碘易升华,不能分液分离,可利用升华法分离,故B错误;
C.水和四氯化碳分层,应利用分液法分离,故C错误;
D.自来水中水的沸点低,利用图中蒸馏装置可分离,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的收集、混合物分离提纯等,把握物质的性质、性质差异及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
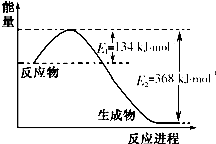 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨既是实验室中常用试剂,也是工业上重要原料.
氨既是实验室中常用试剂,也是工业上重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | N2 | ||
| C. | NO2 | D. | 直径非常小的可吸入颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焚烧秸秆,还肥于田 | B. | 净化废水,循环利用 | ||
| C. | 低碳出行,植树造林 | D. | 开发风能,利用地热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
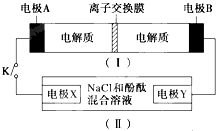 如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为;2K2S2+KI3$?_{充电}^{放电}$K2S4+3KI,装置(Ⅱ)为电解池的示意图当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为;2K2S2+KI3$?_{充电}^{放电}$K2S4+3KI,装置(Ⅱ)为电解池的示意图当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )| A. | 闭合K时,K十从左到右通过离子交换膜 | |
| B. | 闭合K时,A的电极反应式为:3I--2e-═I2- | |
| C. | 闭合K时,X的电极反应式为:2CI--2e-═Cl2↑个 | |
| D. | 闭合K时,当有0.1mo1K+通过离子交换膜,X电极上产生标准状况下气体2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量是98 g | B. | 18 g水中含有水分子数为NA | ||
| C. | O2的摩尔质量等于其相对分子质量 | D. | 1 mol CO的质量为28 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C1=C2 | B. | C1>C2 | C. | C1<C2 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com