
下列 实验方法正确的是
实验方法正确的是
A.除去NaCl固体中少量的NH4Cl,可用加热的方法除去
B.除去NO2气体中少量的NO气体,可通入适量的O2
C.除去FeSO4溶液中少量的Fe2(SO4)3,可加入Cu粉充分反应后过滤
D.除去NaHCO3固体中少量的Na2CO3,可用加热至恒重的方法除去
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是( )
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2===2NH +SO
+SO +H2O
+H2O
B.氯化钠与浓硫酸混合加热:H2SO4+2Cl- SO2↑+Cl2↑+H2O
SO2↑+Cl2↑+H2O
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO ===3Fe3++NO↑+3H2O
===3Fe3++NO↑+3H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO 恰好完全沉淀:2Ba2++3OH-+Al3++2SO
恰好完全沉淀:2Ba2++3OH-+Al3++2SO ===2BaSO4↓+Al(OH)3
===2BaSO4↓+Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y是同一周期的两种主族元素,它们可能组成XY2型共价化合物,X、Y元素在周期表中的原子序数可能是( )。
A、6、8 B、11、17 C、11、16 D、12、17
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,请回答有关问题:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||||||
| 2 | ① | ② | ③ | |||||||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||
| 4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ,④元素原子结构示意图为 ,⑦元素的离子结构示意图为 ,⑨元素的离子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式 。
(3)④元素与⑦元素形成化合物的电子式 ,①元素与⑦元素形成化合物的电子式 ,④元素与⑥元素形成化合物的电子式 ,
⑦元素单质的电子式 ,②元素单质的电子式 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式),④,⑤,⑨三种元素的最高价氧化物的水化物中碱性最弱的是 (填化学式)。④,⑤,⑥、⑦四种元素中非金属性最强的是 (用元素符号表示)。
(5)⑨元素与③元素形成化合物的形成过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在碱性溶液中能大量共存且溶液为无色透明的离子组是
A.K+ 、MnO4-、Na+、Cl- B.K+、Ba2+、NO3-、Cl-
C.Na+、HCO3-、NO3-、SO42- D.Fe3+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应3Cl2+6NaOH 5NaCl+NaClO3+3H2O,以下叙述正确的
5NaCl+NaClO3+3H2O,以下叙述正确的 是
是
A.Cl2是氧化剂,NaOH是还原剂
B.当有6.72L Cl2反应时,转移电子物质的量为0.5mol
C.氧化剂得电子总数与还原剂失电子总数之比为1∶1
D.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
今有如下三个热化学方程式:
H2(g)+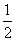 O2(g)=H2O(g);△H= a kJ/mol
O2(g)=H2O(g);△H= a kJ/mol
H2(g)+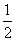 O2(g)=H2O(l);△H= b kJ/mol
O2(g)=H2O(l);△H= b kJ/mol
2H2(g)+ O2(g)=2H2O(l);△H= c kJ/mol
关于它们的下列表述,正确的是
A.它们都是吸热反应 B.a、b和c均为正值
C.反应热的关系:a=b D.反应热的关系:2b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积为2 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g) △H=Q,化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g) △H=Q,化学平衡常数K与温度T的关系如下表:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)Q____0(填 “>”、“<”),升高温度,化学平衡向________(填“正反应”或“逆反应”)方向移动。
(2)若某温度下,平衡浓度符合下列关系:c(CO2)·c(H2)=c(CO)·c(H2O),此时的温度为__________;在此温度下,若该容器中含有1mol CO2、3mol H2、2mol CO、2mol H2O,则此时反应所处的状态为____________(填“向正反应方向进行中”、“向逆反应方向进行中”或“平衡状态”),此温度平衡时CO2的浓度为___________ mol·L-1;在此温度下,若该容器中含有1.5mol CO2、3.5mol H2、1.5mol CO、1.5mol H2O达到平衡时CO2的浓度为___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将该温度下a mL pH=13 NaOH溶液与b mL0.05mol/L H2SO4混合,所得混合溶液的pH=7,
则a:b =
(2)若在含有足量AgCl固体的饱和AgCl溶液中分别放入:A、100mL蒸馏水中;B、100mL 0.2 mol·L-1AgNO3溶液中;C、100 mL 0.1 mol·L-1AlCl3溶液中;D、100mL 0.1 mol·L-1盐酸溶液中。充分搅拌后,银离子浓度最小的是 (填序号)
(3)在25℃下,向浓度均为0.20 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
沉淀(填化学式),生成该沉淀的离子方程式为 ;当测得溶液pH=11.00时,则此温度下残留在溶液中的c(Mg2+):c(Cu2+)=
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.0×10-20)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com