
【题目】下面的排序不正确的是( )
A.多电子原子轨道能量高低:4s>3p>3s>2px=2py
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:NaCl>SiO2>Hg>P4
D.晶格能由大到小:KF>KCl>KB>KI
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙为相互串联的两电解池。
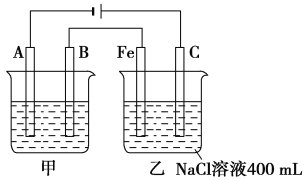
(1)甲池若为用电解原理精炼铜的装置,则A电极名称为________极,电极材料是________,电极反应式为_____________,电解质溶液可以是________。
(2)乙池中Fe极电极反应式为_________,若在乙池中滴入少量酚酞试液,开始通电一段时间,Fe极附近呈________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如图实验装置探究硝酸的性质,根据图示判断下列结论不正确的是( )

A.试管内壁上的“黄霜”的成分是硫
B.该实验既说明了浓硝酸具有氧化性,又说明了浓硝酸具有挥发性
C.烧杯内氢氧化钠溶液的作用是除去尾气,防止尾气毒害
D.试管中浓硝酸可以用浓盐酸代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅陶瓷能代替金属制造发动机的耐热部件。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
A. 容器的温度保持不变 B. 容器的压强保持不变
C. υ正(N2)=6υ逆(HCl) D. 容器内的气体c(N2)∶c(H2)∶c(HCl)=1∶3∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定 O2含量,右图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为aL(标 准状况),某电极增重了b g。下列说法不正确的是( )

A.Pt电极为负极
B.反应过程中转移OH-的物质的量为0.125bmol
C.Pb电极上发生的电极反应为Pb-2e- +2OH- = PbO+H2O
D.待测气体屮氧气的体积分数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.布朗斯特(Brnsted)和劳莱(Lowry)的质子理论认为,凡是给出质子(H+)的任何物质(分子或离子)都是酸;凡是接受质子(H+)的任何物质都是碱。简单地说,酸是质子的给予体,而碱是质子的接受体。酸和碱之间的关系表示如:酸![]() 质子(H+)+ 碱
质子(H+)+ 碱
(1)根据酸碱质子理论,既能看成酸又能看成碱的是_____________。(均填序号)
①![]() ②HS- ③
②HS- ③![]() ④H2O ⑤H3O+ ⑥Na+
④H2O ⑤H3O+ ⑥Na+
(2)已知反应C6H5OH + ![]() =C6H5O - +
=C6H5O - +![]() ,则C6H5O – 和
,则C6H5O – 和![]() -碱性较强的是__________。
-碱性较强的是__________。
Ⅱ.(3)水的离子积常数为Kw ,弱酸HA的电离平衡常数为Ka,NaA的溶液中A-的水解平衡常数为Kh ,根据它们的平衡常数表达式判断,Ka与Kh的关系为__________________。
(4)已知常温下弱酸HA的电离平衡常数为K=1.75× 10-5,常温下向0.2mol/L的HA的溶液中加入等体积0.1mol/L的NaOH溶液,该溶液pH值___7(填“>”或 “=”或 “<”),该溶液粒子浓度关系正确的是____。
A.2c(Na+)> c(HA)+c(A-)
B.c(A-)—c(HA)=2[c(H+)—c(OH-)]
C.c(A-)> c(Na+)> c(HA)> c(H+)>c(OH-)
D.c(Na+)>c(A-)> c(HA)>c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醇为原料制取高纯H2是重要的研究方向。回答下列问题:
(1)甲醇水蒸气重整制氢主要发生以下两个反应。
主反应:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H=+49kJ·mol-1
CO2(g)+3H2(g) △H=+49kJ·mol-1
副反应:H2(g)+CO2(g) ![]() CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
①甲醇在催化剂作用下裂解可得到H2和CO,反应的热化学方程式为__________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②适当增大水醇比[n(H2O):n(CH3OH)],有利于甲醇水蒸气重整制氢,理由是___________。
③某温度下,将n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________(忽略副反应)。
(2)工业上常用CH4与水蒸气在一定条件下来制取H2,其反应原理为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+203kJ·mol-1,在容积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
CO(g)+3H2(g) △H=+203kJ·mol-1,在容积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。

压强为p1时,在N点:v正_______v逆(填“大于”“小于”或“等于”),N点对应温度下该反应的平衡常数K=________mol2·L-2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中不正确的是
A. 某密闭容器中盛有0.2 mol SO2和0.1 mol O2,一定条件下充分反应,生成SO3分子数小于0.2 NA
B. 一定条件下,2.3 g Na与O2完全反应生成3.6 g产物时失去的电子数0.1 NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为 0.1 NA
D. 20g D2O中含有的质子数为10 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com