
氮元素广泛存在于自然界中,对人类生命和生活具有重要意义。含氮元素的化合物在工业生产和国防建设中都有广泛的应用。
(1)氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。PH3分子的空间构型为 ,是 分子。(填极性或非极性)
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)
a.NH3比PH3稳定性强
b.硝酸显强氧化性,磷酸不显强氧化性
c.氮气与氢气能直接化合,磷与氢气很难直接化合
d.氮气常温是气体,磷单质是固体
亚硝酸盐是食品添加剂中急性毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。
(3)亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色变为绿色,反应如下,补上缺项物质并配平:
Cr2O72-+ NO2-+ → Cr3+ + NO3-+
(4)上题反应中每消耗0.6mol NO2-,转移电子数为 。
(5)氮氧化物(NO和NO2)污染环境。若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式为 。
(1)3 2 三角锥形 极性
(2)a c
(3)Cr2O72-+ 3NO2-+ 8H+ →2Cr3+ + 3NO3-+ 4H2O
(4)1.2NA
(5)2NO2+CO32-→ NO2-+NO3-+CO2
解析试题分析:(1)氮元素的原子序数是7,其核外电子排布为1s22s22p3,原子核外有3个未成对电子,最外层有2种能量不同的电子。PH3分子中P原子含有1对孤对电子,价电子数是4,所以其空间构型为三角锥形,是极性分子。
(2)a.非金属性越强,氢化物的稳定性越强,因此NH3比PH3稳定性强可以说明二者非金属性相对强弱,a正确;b.硝酸显强氧化性,磷酸不显强氧化性与非金属性强弱无关系,b不正确;c.非金属性越强,越容易与氢气化合,因此氮气与氢气能直接化合,磷与氢气很难直接化合可以说明二者非金属性相对强弱,c正确;d.氮气常温是气体,磷单质是固体,非金属性强弱与状态无关系,d不正确,答案选ac。
(3)根据方程式可知Cr元素的化合价从+6价降低到+3价,得到3个电子。氮元素的化合价从+3价升高到+5价,失去2个电子,所以根据电子得失守恒可知配平后的方程式为Cr2O72-+ 3NO2-+ 8H+ →2Cr3+ + 3NO3-+ 4H2O。
(4)氮元素的化合价从+3价升高到+5价,失去2个电子,所以每消耗0.6mol NO2-,转移电子数为0.6×2×NA=1.2NA。
(5)9.2gNO2的物质的量是9.2g÷46g/mol=0.2mol,反应中转移0.1mol电子,所以在反应中NO2部分不还原为亚硝酸根,另外一部分转化为硝酸根,所以反应的离子方程式为2NO2+CO32-→ NO2-+NO3-+CO2。
考点:考查核外电子排布、非金属性强弱比较以及氧化还原反应的有关应用与计算


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:单选题
实验室可用NaNO2+NH4Cl =NaCl+N2↑+2H2O制备N2,下列说法正确的是
| A.NaNO2发生氧化反应 |
| B.NH4Cl中的氮元素被还原 |
| C.N2既是氧化产物,又是还原产物 |
| D.每生成1mol N2转移电子的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式
(2)已知:Se+2H2SO4(浓) = 2SO2↑+SeO2+2H2O 2SO2+SeO2+2H2O = Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O ②I2+2Na2S2O3 = Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
Cu+2H2SO4(浓)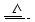 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于 (用字母代号填写)
A.酸 B.碱 C.盐 D.酸性氧化物 E.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中 (填写化学式,下同)失去电子,氧化剂是 。
(2)若A物质通入品红溶液,观察到溶液褪色,说明A物质具有 (填序号,下同);若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
A.氧化性 B.还原性 C.漂白性
若A物质通入双氧水,请大胆判断所得溶液是 (填溶质的化学式)
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为 L (假设气体全部逸出)。若用4 mol·L-1的NaOH溶液吸收生成的A,并生成正盐,写出发生的反应方程式 计算需要NaOH溶液的体积 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(17分)H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:____________
②设计实验方案:在不同H2O2浓度下,测定 ____________________________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成下图的装置示意图。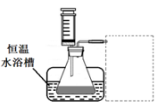
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。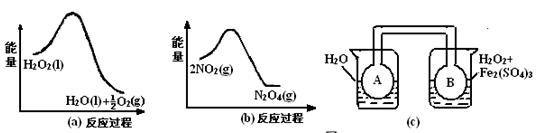
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请将5种物质:N2O、FeCl2、Fe(NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1) + → + + +H2O(不需配平)
(2)反应过程中,N2O与FeCl2的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下: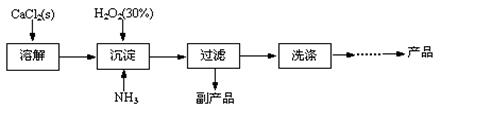
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200mol·L—1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据计算产品中CaO2·8H2O的质量分数(写出计算过程):
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型
与氧化还原反应的关系”也可用如图表达。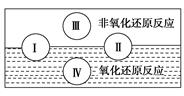
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________,其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl Cu+____CuCl2+N2↑+____H2O。
Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
(3)(2011·福建高考卷节选)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10,10C+P4O10=P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-=NO↑+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:__________________________________。
(2)反应中硝酸体现了______________、______________的性质。
(3)反应中若产生0.2 mol气体,则转移的电子的物质的量是________ mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com