
| A. |  三脚架 | B. |  蒸发皿 | C. |  坩埚钳 | D. |  泥三角 |
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移时,要用玻璃棒引流 | |
| B. | 托盘天平称取58.50克食盐,加水配制成1升溶液,NaCl溶液浓度为1mol•L-1 | |
| C. | 溶解食盐的烧杯要洗涤2~3次并将洗涤液转移到容量瓶中 | |
| D. | 搅拌可加速溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,若D最外层只有两个电子,则D的原子结构示意图
,若D最外层只有两个电子,则D的原子结构示意图 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5+3-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物的水化物能溶于稀氨水 | |
| D. | Z的最高价氧化物的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
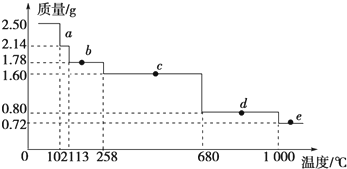
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com