
【题目】对氨基苯甲酸酯类是一类局部麻醉药,化合物M是该类药物之一。合成M的一种路线如下:

已知以下信息:
①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢。
② 。
。
③E为芳香烃,其相对分子质量为92。
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的结构简式为_________________,其化学名称是_____________________。
(2)由E生成F的化学方程式为_________________________________________。
(3)由G生成H的反应类型为__________________,H在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式__________________________________________________。
(4)M的结构简式为________________________________。
(5)D的同分异构体中不能与金属钠反应生成氢气的共有_________种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是_________________(写结构简式)。
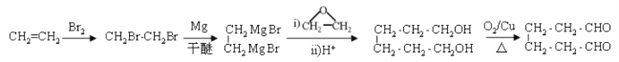
(6)参照上述合成路线,以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛,设计合成路线 ___________________________________________________________________。
【答案】 ![]() 2—甲基丙烯
2—甲基丙烯 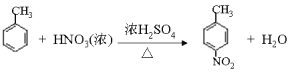 还原反应 n
还原反应 n ![]()
![]()
![]() +(n—1)H2O
+(n—1)H2O 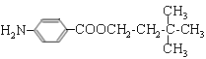 15
15 ![]()
【解析】A与溴化氢发生加成反应生成B,磁共振氢谱显示B只有一种化学环境的氢,则B的结构简式为CBr(CH3)3,则A的结构简式为CH2=C(CH3)2。根据已知信息②可知C与环氧乙烷反应生成D,则D的结构简式为(CH3)3CCH2CH2OH。E为芳香烃,其相对分子质量为92,则E是甲苯,甲苯发生硝化反应生成F,由于H苯环上有两种化学环境的氢,这说明硝基在甲基的对位,即F的结构简式为![]() 。由于氨基易被氧化,所以F生成G是甲基的氧化反应,引入羧基,即G的结构简式为
。由于氨基易被氧化,所以F生成G是甲基的氧化反应,引入羧基,即G的结构简式为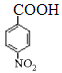 。G中的硝基被还原转化为氨基,则H的结构简式为
。G中的硝基被还原转化为氨基,则H的结构简式为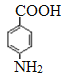 。H和D发生酯化反应生成M,则M的结构简式为
。H和D发生酯化反应生成M,则M的结构简式为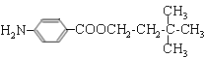 。
。
(1)根据以上分析可知A的结构简式为![]() ,其化学名称是 2-甲基丙烯。(2)由E生成F的化学方程式为
,其化学名称是 2-甲基丙烯。(2)由E生成F的化学方程式为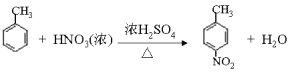 。(3)由G生成H的反应类型为还原反应,H分子中含有羧基和氨基,在一定条件下可以发生聚合反应,该聚合反应的化学方程式 n
。(3)由G生成H的反应类型为还原反应,H分子中含有羧基和氨基,在一定条件下可以发生聚合反应,该聚合反应的化学方程式 n![]()
![]()
![]() +(n—1)H2O。(4)M的结构简式为
+(n—1)H2O。(4)M的结构简式为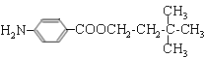 。(5)D的同分异构体中不能与金属钠反应生成氢气,说明含有醚键,可以是甲醇和戊醇形成,戊基有8种,相应醚有8种;可以是乙醇和丁醇形成,丁醇有4种,相应醚有4种;可以是2分子丙醇形成,丙醇有2种,相应的醚类有3种,共计15种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是
。(5)D的同分异构体中不能与金属钠反应生成氢气,说明含有醚键,可以是甲醇和戊醇形成,戊基有8种,相应醚有8种;可以是乙醇和丁醇形成,丁醇有4种,相应醚有4种;可以是2分子丙醇形成,丙醇有2种,相应的醚类有3种,共计15种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是![]() 。(6)参照上述合成路线和题干信息可知以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛的合成路线为
。(6)参照上述合成路线和题干信息可知以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛的合成路线为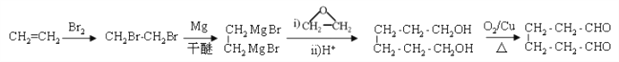 。
。


科目:高中化学 来源: 题型:
【题目】下列装置有关说法错误的是

A. 装置Ⅰ:可以用来验证碳的非金属性比硅强
B. 装置Ⅱ:可以用来比较Na2CO3和NaHCO3的热稳定性
C. 装置Ⅲ:先从①口进气收集满二氧化碳,再从②口进气,可收集NO气体
D. 装置Ⅳ:制备Fe(OH)2并能保证较长时间观察到白色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
(1)二价铜离子的电子排布式为 。已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释 。
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。

(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为 ,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是 。
(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3在BF3·NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 。
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 。
六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3。(只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:图1中a和b分别为常温下盐酸和NaOH溶液互滴的pH变化曲线;图2为常温下CaSO4在水中的沉淀溶解平衡曲线[Ksp(CaSO4)=9×10-6]。下列相关叙述正确的是
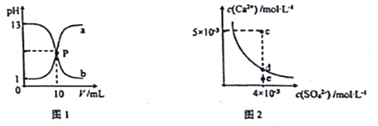
A. 图1中P点溶液:c(Na+)= c(Cl-)>c(H+) = c(OH-)
B. 由图1可知盐酸和NaOH溶液的浓度均为1mol·L-1
C. 图2中c点有沉淀生成,达平衡后溶液中c(SO42-)=3×10-3 mol·L-1
D. 可通过蒸发将图 2中e点的溶液变到d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂试剂或方法有错误的是( )
原物质 | 所含杂质 | 除杂试剂 | 主要操作方法 | |
A | HNO3溶液 | H2SO4 | BaCl2溶液 | 过滤 |
B | CO2 | SO2 | 酸性KMnO4溶液、浓硫酸 | 洗气、干燥 |
C | SiO2 | Al2O3 | 稀盐酸 | 过滤 |
D | C2H5OH | CH3COOH | CaO | 蒸馏 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为_____________
(2)与阴离子(CN-)互为等电子体的两种分子有______________、____________________
(3)氨水溶液中存在多种氢键,任表示出其中两种_________________、_________________.
(4)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13。硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因是______________
②硝酸比亚硝酸酸性强的原因是______________

(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的核外电子排布式为_________________与同一个N3-相连的X+有_____ 个。
(6)X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为________________该化学键能形成的原因是___________________请画出[X(H2O)4]2+离子的结构式(用元素符号写结构式)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的Cl-浓度与50mL 1mol·L-1氯化铝溶液中的Cl-浓度相等的是
A.150mL、1 mol·L-1 氯化钠溶液
B.75mL、2 mol·L-1 氯化铵溶液
C.150mL、1 mol·L-1 氯化钾溶液
D.75mL、1mol·L-1 氯化铝溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com