
分析 (1)根据配制一定物质的量浓度的溶液步骤及中和滴定的操作方法进行排序;
(2)滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,注意滴定管的精确值;
(3)锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨;
(4)锥形瓶不需要洗涤,否则待测液中溶质的物质的量偏大,滴定过程中消耗的标准液体积偏大,则测定的浓度偏高;
(5)根据反应消耗的硫酸,求出氢氧化钠的物质的量、质量,进一步求出样品的纯度.
解答 解:(1)在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解,在250mL的容量瓶中配制250mL烧碱溶液,用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞做指示剂,将物质的量浓度为c的标准硫酸溶液装入酸式滴定管.调整液面记下开始读数为V1mL,在锥形瓶下垫一张白纸,滴定至红色刚好消失为止,记下读数V2mL,故正确的操作顺序为:C→A→B→D→E,
故答案为:C→A→B→D→E;
(2)观察滴定管液面的高度时需要注意:滴定管要直立,装液后需等1~2 min后才能观察液面高度;读数时视线与液体的凹液面及刻度线在同一水平面上,读数应准确至0.01 mL,
故答案为:滴定管要直立,装液后需等1~2 min后才能观察液面高度;读数时视线与液体的凹液面及刻度线在同一水平面上,读数应准确至0.01 mL;
(3)锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨,方法是垫一张白张是为了使颜色变化更为明显,易于判断滴定终点;
故答案为:使滴定终点颜色变化更明显,便于分辨;
(4)中和滴定中,锥形瓶不能用待测液润洗,否则因碱液样品沾在锥形瓶内壁使烧碱的物质的量增加,耗用标准酸的体积偏大,导致测定出的烧碱浓度偏高,
故答案为:偏高;因碱液样品沾在锥形瓶内壁使烧碱的物质的量增加,耗用标准酸的体积偏大,故烧碱浓度偏高;
(5)滴到消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×m mol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2M(V2-V1)×10-3mol,
所以原来样品中氢氧化钠的物质的量为:2M(V2-V1)×10-3mol×$\frac{250mL}{25mL}$×2M(V2-V1)×10-2mol,
则样品中氢氧化钠的质量为:m(NaOH)=nM=80M(V2-V1)×10-2g,
则该烧碱样品的纯度为:$\frac{80M({V}_{2}-{V}_{1})×1{0}^{-2}g}{Wg}$×100%=$\frac{0.8M({V}_{2}-{V}_{1})}{W}$×100%;
故答案为:$\frac{0.8M({V}_{2}-{V}_{1})}{W}$×100%.
点评 本题考查了探究烧碱样品的纯度的方法,题目难度中等,涉及酸碱中和滴定、质量分数的计算、化学实验基本操作方法的判断等知识,注意掌握中和滴定操作方法,明确常见化学实验基本操作方法,试题培养了学生的分析能力及化学计算、化学实验能力.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
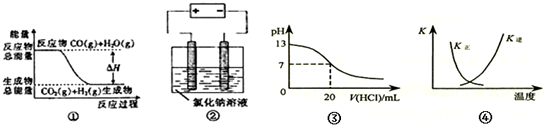
| A. | 图①表示可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)中的△H大于0 | |
| B. | 图②是石墨为电极电解氯化钠稀溶液,阴、阳两极产生气体体积之比一定为1:1 | |
| C. | 图③表示25℃,0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,pH随加入酸体积的变化 | |
| D. | 图④表示2SO2(g)+O2(g)?2SO3(g)△H<0 正、逆反应平衡常数K随温度的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
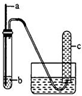 按如图所示装置选取不同试剂组进行实验,下列实验现象预期和结论均正确的是
按如图所示装置选取不同试剂组进行实验,下列实验现象预期和结论均正确的是| a | b | 实验现象预期 | 结论 | |
| A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
| B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
| C | 生铁 | 饱和NaCl溶液 | 导管中发生倒吸 | 生铁发生吸氧腐蚀 |
| D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁做催化剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)的键能之和大于2 mol SO3(g)的键能 | |
| B. | 一定量SO2(g)和O2(g)置于密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| C. | 恒温恒压下,在上述已达到平衡的体系中加入高效催化剂,SO2的转化率一定增大 | |
| D. | 将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 89.6mL | B. | 112mL | C. | 224 mL | D. | 448mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com