
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
![]()
A. X的气态氢化物比Y的稳定
B. W的最高价氧化物对应水化物的酸性比Z的强
C. Z的非金属性比Y的强
D. X与Y形成的化合物都易溶于水
【答案】B
【解析】试题分析:X、Y、Z、W均为短周期元素,即四种元素的原子序数不大于18,Y原子的最外层电子是内层电子数的3倍,内层只能是第一电子层,第一电子层有2个电子,第二电子层有6个电子,所以Y是O元素;X、Y属于同一周期且相邻,所以X是N元素;Y、Z属于同一主族,且Z在Y的下一周期,所以Z是S元素;W和Z是同一周期元素,且W、Z相邻,所以W是Cl元素。A.X和Y属于同一周期,Y的原子序数大于X的,Y的非金属性大于X的,所以Y的气态氢化物比X的稳定,A项错误;B.Z和W属于同一周期的元素,W的原子序数大于Z的,所以W的非金属性大于Z的,W的最高价氧化物的水化物的酸性大于Z的,B项正确;C.Y和Z属于同一主族的元素,Z的原子序数大于Y的,所以Y的非金属性比Z强,C项错误;D.X与Y形成的化合物有NO、NO2、N2O3等化合物,NO难溶于水,D项错误;答案选B。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】室温下将l0mL c(H+)=0.00lmol/L的醋酸溶液加水稀释10倍后,下列说法正确的是( )
A. 醋酸的电离程度增大,c(H+)亦增大
B. 溶液中 不变
不变
C. 溶液中导电粒子的数目增多
D. 再加入l0mL c(OH-)=0.00lmol/L的NaOH溶液,混合液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M,R,X,Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:
(1)R基态原子的电子排布式是 , X和Y中电负性较大的是(填元素符号).
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 .
(3)X与M形成的XM3分子的空间构型是 .
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是(填离子符号). 
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,b和c为两种常见的金属元素,a、b、c、d的最高价氧化物对应的水化物依次为甲、乙、丙、丁,它们之间存在如图所示的反应关系(图中用“--“相连的两种物质间能发生反应)。下列判断一定正确的是

A. 简单离子半径:d>b>c>a
B. 等物质的量的ba3、b3a所含离子总数不相等
C. d的最高化合价和最低化合价的代数和为6
D. b和d组成的化合物的水溶液是中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知: 氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。
I.制备氢化锂
选择图I中的装置制备氢化锂(有些装置可重复使用):
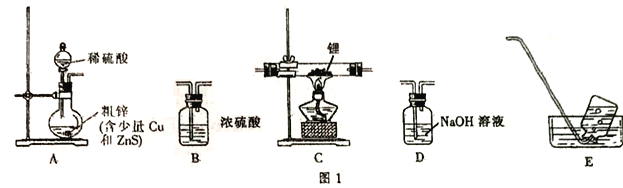
(1)装置的连接顺序(从左至右)为A→______________。
(2)检在好装蹬装置的气密性,点燃酒精灯前需进行的实验操作是_______________。
(3)写出制备氢化铝锂的化学方程式:__________________。
II. 制备氢化铝锂
1947年,Schlesinger,Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅样,充分反应后,经一系列操作得到LiAlH4晶体。
(4)写出氢化锂与无水三氯化铝反应的化学方程式:____________________。
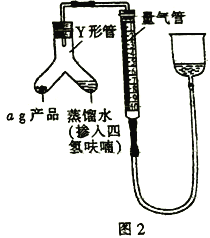
III.测定氢化铝锂产品(不含氢化锂)的纯度
(5)按图2装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是________。读数之前上下移动量气管右侧的容器,使量气管左、右有两侧的液面在同一水平面上,其目的是_________。
(6)在标准状况下,反应前量气管读数为V1mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为_____________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1mol任何物质都含有约6.02×1023个原子
B.常温下,22.4LSO2所含的分子数为NA
C.摩尔是物质的量的单位
D.H2O 的摩尔质量是18g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.水的电离方程式:H2O=H++OH﹣
B.pH=7的溶液一定是中性溶液
C.升高温度,水的电离程度增大
D.将稀醋酸加水稀释时,c(H+)减小,c(OH﹣)也减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试回答下列各题:
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ______________________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
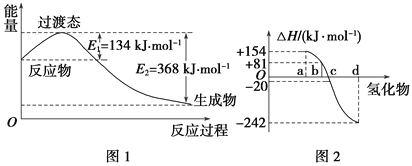
请填空:
共价键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 247 | ________ |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式: ___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)aFeb(SO4)c·dH2O又称莫尔盐,是浅绿色晶体,用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
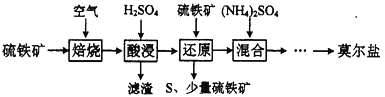
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:
FeS2 +14Fe3++8H2O =15Fe2++2SO42-+16H+
(1)写出“还原”时Fe3+与FeS2发生还原反应Ⅱ的离子方程式:__________________________。实验室检验“还原”已完全的方法是:__________________________。
(2)称取11.76g新制莫尔盐,溶于水配成250mL溶液。取25.00mL该溶液加入足量的BaCl2溶液,得到白色沉淀1.398g;另取25.00mL该溶液用0.0200mol/LKMnO4酸性溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗溶液的体积为30.00mL。试确定莫尔盐的化学式(请写出计算过程)_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com