
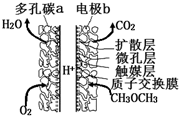
 一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )
一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )| A. | 多孔碳a能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 电极b上发生的反应为:CH3OCH3-12e-+3H2O═2CO2+12H+ | |
| C. | H+由b电极向a电极迁移 | |
| D. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇(CH3OH)直接燃料电池能量密度的1.4倍 |
分析 A、采用多孔导电材料,可以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,而该极是氧气放电,所以是正极;
B、电极b是负极发生氧化反应;
C、阳离子向正极移动;
D、二甲醚提供1mol电子所需质量为:$\frac{46}{12}$g,而甲醇(CH3OH)提供1mol电子$\frac{30}{6}$g.
解答 解:A、采用多孔导电材料,可以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,而该极是氧气放电,所以是正极,而不是负极,故A错误;
B、电极b是负极发生氧化反应,电极反应式为:CH3OCH3-12e-+3H2O═2CO2+12H+,故B正确;
C、阳离子向正极移动,所以H+由b电极向a电极迁移,故C正确;
D、二甲醚提供1mol电子所需质量为:$\frac{46}{12}$g,而甲醇(CH3OH)提供1mol电子$\frac{30}{6}$g,所以二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇(CH3OH)直接燃料电池能量密度为:$\frac{\frac{30}{6}}{\frac{46}{12}}$约为1.4倍,故D正确;
故选A.
点评 本题考查了燃料电池,明确正负极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液的酸碱性书写,注意电子不能在溶液中移动,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2 | |
| C. | 氯化铝与过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 硫酸氢钠与氢氧化钡1:1反应:SO42-+H++Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | 只有⑤ | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L1mol/LNaF溶液中含Na+和F-之和为4NA | |
| B. | 在常温常压下,22gCO2含有的共用电子对数为2NA | |
| C. | 7.1g氯气与足量的NaOH溶液反应,转移电子数为0.2NA | |
| D. | 11mol甲基(-CH3)中所含电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应开始前,检查装置的气密性 | |
| B. | 加入过量稀硫酸,以确保镁带完全反应 | |
| C. | 反应停止后,立即调压并记录读数 | |
| D. | 常温下1mol氢气的体积为$\frac{V({H}_{2})}{m(Mg)}$×M(Mg) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物不一定都能与水反应生成酸 | |
| B. | 某溶液加入盐酸酸化的BaCl2溶液产生白色沉淀,则原溶液中含有SO42- | |
| C. | 丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 现代化学分析测试常借助一些仪器来分析物质组成,如用原子吸收光谱确定物质中含有那些金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
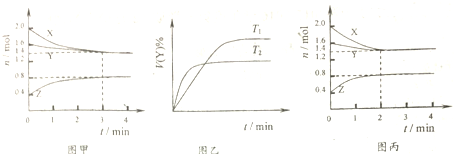
| A. | T1℃时,容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g),且正反应放热 | |
| B. | T1℃时,反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | T1℃时,3min达到平衡后,向容器中再加入2.0mol X、1.6mol Y、0.4mol Z,反应达到新平衡时:0.7mol•L-1<c(Y)<1.4mol•L-1 | |
| D. | 若改变反应条件,使反应进程如图丙所示,则改变的条件是使用催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com