
【题目】工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备FeSO4·7H2O(绿矾)的流程如下:
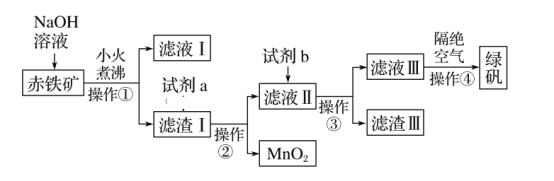
(1)实验室中操作①的名称为____。所需的玻璃仪器有烧杯、______、_____。
(2)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为_______________________。
(3)加入滤渣Ⅰ中的试剂a是___________,滤液Ⅱ中的主要金属阳离子有_____。
(4)试剂b为__________________。
(5)滤渣Ⅲ中的主要成分是____________。操作④隔绝空气的目的是___________。
【答案】过滤 漏斗 玻璃棒 Al2O3+2OH-===2AlO![]() +H2O 硫酸(或H2SO4) Fe3+、Fe2+、Cu2+ Fe Cu、Fe 防止溶液中的Fe2+被空气氧化为Fe3+
+H2O 硫酸(或H2SO4) Fe3+、Fe2+、Cu2+ Fe Cu、Fe 防止溶液中的Fe2+被空气氧化为Fe3+
【解析】
赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等),由制备流程可知,加NaOH后,Al2O3与NaOH反应,则滤液I中含OH-、AlO2-,滤渣I中含Fe2O3、FeO、MnO2、CuO,加试剂a为硫酸,操作①②均为过滤,滤液Ⅱ中含硫酸、Fe2(SO4)3、FeSO4、CuSO4,试剂b为Fe,操作③为过滤,滤渣Ⅲ为Cu、Fe,滤液Ⅲ含FeSO4,蒸发浓缩、冷却结晶得到绿矾,以此来解答。
(1)操作①的目的为固液分离,则操作名称为过滤,该操作所需的玻璃仪器有烧杯、漏斗、玻璃棒;
(2) NaOH溶液加入赤铁矿中,氧化铝溶于NaOH溶液生成NaAlO2和水,发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;
(3) 试剂a为硫酸,溶解Fe2O3、FeO和CuO,,则滤液Ⅱ中的主要金属阳离子有Fe3+、Fe2+和Cu2+;
(4)加入试剂b的目的是将Fe3+还原为Fe2+,同时除去Cu2+,则在不引入新的杂质的基础上,试剂b应选择Fe;
(5)在含有Fe3+、Fe2+和Cu2+的溶液中加入过量铁粉,将Fe3+还原为Fe2+,同时除去Cu2+,则过滤所得滤渣Ⅲ中的主要成分是Fe、Cu;亚铁离子不稳定,易被空气氧化生成铁离子,所以操作④隔绝空气的目的是防止溶液中的Fe2+被空气氧化为Fe3+。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法中正确的是( )
A.标准状况下,11.2L CCl4中含有的分子数目为0.5 NA
B.1 mol Fe参与反应失去电子数目一定为2NA
C.1 molNa被完全氧化生成Na2O2,失去2NA个电子
D.常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | Si | SiO2 | H2SiO3 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中常用炼锌废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来提取氧化锌和金属铜等,其主要工艺流程如图所示:
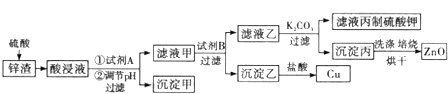
有关氢氧化物开始沉淀和沉淀完全的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 5.4 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 | 6.7 | 8.0 |
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条) ______
(2)试剂A是 ______ (填化学式).
(3)调节酸浸液的pH的范围是 ______.
(4)滤液甲与试剂B发生置换反应,则试剂B是 ______ (填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)AgNO3的水溶液呈________________(填“酸”、“中”、“碱”)性,常温时的pH_____7(填“>”、“=”、“<”),原因是(用离子方程式表示):_______________________________________________________________________________________;
实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以____________(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈_______性 ,原因是(用离子方程式表示):_____________________________________________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________________。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质。常温下,E是一种无色无味的液体,它们之间有如下反应关系。
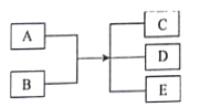
(1)若A是一种具有磁性的黑色金属氧化物,B是一种常见的非氧化性酸,A和B反应的离子方程式为__;若在生成物C中继续滴加氢氧化钠溶液,会观察到生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色,写出白色沉淀发生化学反应的方程式__。A与CO高温下反应可得到金属单质,写出该金属单质与水蒸气反应的化学方程式__。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
A. 9.6gB. 6.4 gC. 3.2 gD. 2.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向某容积恒定的密闭容器中充入1 mol N2、3 mol H2,经充分反应后达到如下平衡:N2(g)+3H2(g)![]() 2NH3(g),下列有关说法中正确的是( )
2NH3(g),下列有关说法中正确的是( )
A. 达平衡后再加入一定量的N2,体系内各物质含量不变
B. N2、H2、NH3的浓度一定相等
C. 反应没有达到平衡时,NH3会不断地分解,达到平衡时则不会再分解
D. 平衡时,N2、H2物质的量之比为1∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com