
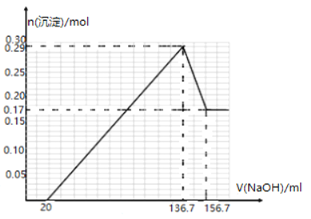
【题目】某镁铝合金MgxAly(其中x、y为整数)是贮氢材料,可在通入氩气的条件下,将一定化学计量比的Al、Mg单质在一定温度下熔炼制得.为测定该合金的成分,称取一定质量的样品放入600mL稀硫酸中,样品全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与NaOH溶液的体积关系如图所示.完成下列问题:
(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是_____________。
(2)NaOH溶液的物质的量浓度为____________。
(3)该镁铝合金(MgxAly)的化学式为_____________。
(4)该合金在一定条件下吸氢的化学方程式为:MgxAly+xH2═xMgH2+yA1,得到的混合物在6.0mol·L-1HCl溶液中能完全释放出H2,1mol MgxAly完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为__________________。
(5)将该镁铝合金置于NaOH溶液可以构成原电池,写出负极发生的反应_____________________。
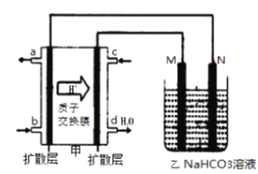
(6)如图甲为甲醇燃料电池,乙池为铝制品表面“钝化”装置,两极分别为铝制品和石墨.M电极的材料是_________________。
【答案】防止镁铝被空气氧化 6mol·L﹣1 Mg17Al12 52mol Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O Al
【解析】
(1)金属镁和铝容易被氧气氧化,进入氩气可以防止镁铝被氧化;
(2)根据图2加入136.7mL氢氧化钠溶液时恰好生成0.29mol氢氧化铝和氢氧化铝沉淀,加入156.7mL氢氧化钠溶液时,沉淀被溶解的为氢氧化铝,据此可以计算出氢氧化铝、氢氧化铝的物质的量,根据质量守恒可知镁铝的物质的量之比;
(3)根据氢氧化铝与氢氧化钠反应的方程式及氢氧化铝的物质的量、氢氧化钠的体积计算出氢氧化钠的浓度;
(4)释放出的H2包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气;
(5)镁铝合金置于NaOH溶液构成原电池,总反应为![]() ,Al失去电子发生氧化反应为负极;
,Al失去电子发生氧化反应为负极;
(6)由装置图可知,b极通入气体后产生气体,c极通入气体后产生水,故b极通入为甲醇,c极通入的是氧气,原电池负极发生氧化反应,正极反应还原反应,所以b为正极,c为负极,M连接的为电源正极,则M为阳极,Al在阳极放电;
(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是防止镁铝被空气中的氧气氧化,
故答案为:防止镁铝被空气氧化;
(2) 溶解0.12mol氢氧化铝消耗氢氧化钠的体积为:(156.7136.7)mL=20mL,根据反应方程式![]() 可知,氢氧化钠的物质的量浓度为:
可知,氢氧化钠的物质的量浓度为:![]() ,
,
故答案为:6mol·L﹣1;
(3) 氢氧化镁和氢氧化铝总物质的量为:0.29mol,加入过量氢氧化钠溶液后,剩余的0.17mol沉淀为氢氧化镁,则氢氧化铝沉淀的物质的量为0.12mol,根据质量守恒定律可知,原合金中镁和铝的物质的量之比为:0.17mol:0.12mol=17:12,所以该镁铝合金(MgxAly)的化学式为:Mg17Al12,
故答案为:Mg17Al12;
(4)1mol Mg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,1mol Mg17Al12完全反应生成氢气的物质的量分别为地17mol、18mol,则生成氢气一共(17+17+18)mol=52mol,
故答案为:52mol;
(5)由于镁不与氢氧化钠溶液反应,所以负极为铝,电解质为氢氧化钠溶液的负极反应为:![]() ,
,
故答案为:![]() ;
;
(6)由装置图可知,b极通入气体后产生气体,c极通入气体后产生水,故b极通入为甲醇,c极通入的是氧气,原电池负极发生氧化反应,正极反应还原反应,所以b为正极,c为负极,M连接的为电源正极,则M为阳极,Al在阳极放电;
故答案为:Al。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数一定相同的是( )
A.1 g H2和8 g O2B.标况时,18 L H2O和18 L CO2
C.0.1 mol HCl和2.24 L HeD.28 g CO和6.02×1023个CO分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气与适量氯气混合反应可生成NH4Cl(岩脑砂的主要成分)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。
A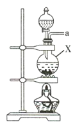 B
B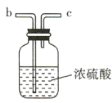
C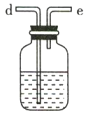 D
D
(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为 ________________ 。
(2)要得到干燥纯净的氯气,A、B、C装置中导管的连接顺序为a→ ________________ → ________________ → ________________ → ________________ 。
(3)利用D装置,将适量氨气与氯气充分混合,氨气应从__________ 通入,反应的化学方程式为 ___________;可能观察到的现象是________________。
(4)现取岩脑砂进行NH4Cl含量的测定。准确称取一定质量的岩脑砂,与足量的氧化铜混合,如图所示进行实验。已知:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O
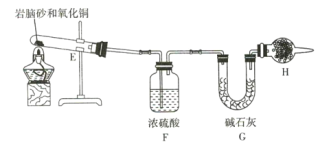
①为顺利完成有关物理量的测定,请完善下列表格。
测量时间点 | 反应前 | 反应后 |
测量内容 | ________________ | 当观察到 ________________ 现象时停止加热,冷却,称量H装置的总质量 |
②如果不用H装置,测出NH4Cl的含量将 _____ (填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邮票是国家邮政发行的一种邮资凭证,被誉为国家名片。新中国化学题材邮票展现了我国化学的发展和成就,是我国化学史不可或缺的重要文献。下列说法错误的是
A. 邮票中的人物是侯德榜。其研究出了联产纯碱与氯化铵化肥的制碱新工艺,创立了中国人自己的制碱工艺一侯氏制碱法
邮票中的人物是侯德榜。其研究出了联产纯碱与氯化铵化肥的制碱新工艺,创立了中国人自己的制碱工艺一侯氏制碱法
B. 邮票中的图是用橡胶生产的机动车轮胎。塑料、橡胶和纤维被称为三大合成材料,它们不断替代金属成为现代社会使用的重要材料
邮票中的图是用橡胶生产的机动车轮胎。塑料、橡胶和纤维被称为三大合成材料,它们不断替代金属成为现代社会使用的重要材料
C. 邮票中的图是显微镜视野下的结晶牛胰岛素。我国首次合成的人工牛胰岛素属于蛋白质
邮票中的图是显微镜视野下的结晶牛胰岛素。我国首次合成的人工牛胰岛素属于蛋白质
D. 邮票是纪念众志成城抗击非典的邮票。冠状病毒其外壳为蛋白质,用紫外线、苯酚溶液、高温可以杀死病毒
邮票是纪念众志成城抗击非典的邮票。冠状病毒其外壳为蛋白质,用紫外线、苯酚溶液、高温可以杀死病毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素M、X、Y、Z的原子序数依次增大,湿润的红色石蕊试纸遇M的气态氢化物变蓝色。含X、Y和Z三种元素的化合物R有如下转化关系(已知酸性强弱:HClO3>HNO3)。下列说法正确的是
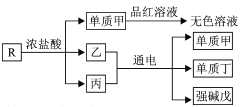
A.简单离子半径:Y>Z>M>X
B.简单气态氢化物的热稳定性:M>X
C.加热单质甲与品红溶液反应所得的“无色溶液”,可变成红色溶液
D.常温下,向蒸馏水中加入少量R,水的电离程度可能增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了测定某铁碳合金中铁的质量分数,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
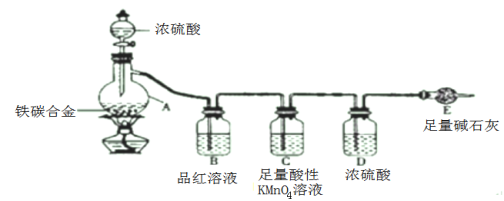
(1)按图示的连接装置,检查装置的气密性并称量E的质量。将10克铁碳合金样品放入A中,再加入适量的浓硫酸,仪器A的名称为_________________。未点燃酒精灯前,A、B均无明显现象 。
(2)点燃酒精灯一段时间后,A、B中可观察到明显的现象。写出A中浓硫酸参与反应的化学方程式 __________________(任写一个)。C装置的作用是 _____________ 。
(3)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________。
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重1.1克。则铁碳合金中铁的质量分数为 _________________ 。
(5)该装置存在一些缺陷,使得测定结果可能会产生误差,请指出该装置的缺陷__________ 、 __________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的反应为SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,此温度下,该反应的平衡常数为
SO3(g) △H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,此温度下,该反应的平衡常数为
A.1B.3C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2),非平面结构,常温下是一种黄红色液体,有刺激性恶臭,熔点80℃,沸点135.6℃,对干二氯化二硫叙述正确的是
A.二氯化二硫的电子式为![]()
B.分子中既有极性键又有非极性键
C.二氯化二硫属于非极性分子
D.分子中S-Cl键能小于S-S键的键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合液25mL,向其中逐渐加入铁粉,产生气体的物质的量随铁粉质量增加的变化如图所示(硝酸的还原产物为NO,忽略反应中的溶液体积变化)。下列有关说法错误的是( )

A.OA段产生的气体是NO,AB段发生的反应为Fe+2Fe3+=3Fe2+,BC段产生的气体是H2
B.由此推断该条件下,氧化性:NO3-强于Fe3+
C.OA段与BC段产生的气体的体积比为1:1
D.C点溶质的物质的量浓度为10 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com