
把Ba (OH)2溶液滴入明矾溶液中,使SO2-4全部转化为BaSO4沉淀,此时铝元素的主要存在形式是( )
A.A13+ B.A1(OH)3 C.A1O2- D.A13+和A1(OH)3
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
A.②和③ B.②和④ C.②③④ D.①③⑤
查看答案和解析>>
科目:高中化学 来源:2013届广东省六校高三第一次联考化学试卷(带解析) 题型:实验题
(10分)SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案: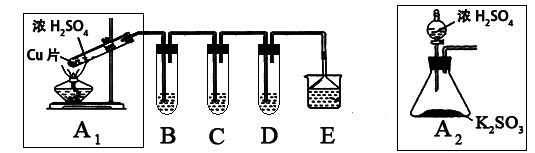
⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:____________________________________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体_______________ _______________________________________________________ | _________________________ ____________________________ |
| 步骤3______________________________________________ ____________________________________________________ | _________________________ _________________________ |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省赣州市六校高三上学期期末联考理综化学试卷(解析版) 题型:选择题
纯碱(Na2CO3) 在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图:

已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl。请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。
精制除杂的步骤顺序a→_______→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣;
b.加入盐酸调pH;
c.加入Ba(OH) 2溶液;
d.加入Na2CO3溶液;
e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是_____________________。
(2)灼烧固体A制Na2CO3应在_____(填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是 。对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3,使pH降低,反应的离子方程式______________________。
(3)下图装置中常用于实验室制备CO2的是_____(填字母编号);用b示意的装置制备NH3时,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂 (填试剂名称)。

(4)一种天然碱晶体成分是aNa2CO3·bNa2SO4·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实验方案。请把实验方案补充完整(仪器自选):
供选择的试剂:1.0 mol·L-1H2SO4溶液、1.0 mol·L-1BaCl2溶液、稀氨水、碱石灰、Ca(OH) 2溶液、蒸馏水
①称取m1 g一定量天然碱晶体样品,溶于适量蒸馏水中;
②_________________________________________________________________;
③_________________________________________________________________;
④计算天然碱晶体中含Na2CO3的质量分数。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济南市高三4月巩固性训练理综化学试卷(解析版) 题型:实验题
纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图

已知:向饱和食盐水中通入NH3,CO2后发生和反应为NaCl+NH3+CO2+H2O NaHCO3↓+NH4Cl,请回答以下问题:
NaHCO3↓+NH4Cl,请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-等。
精制除杂的步骤顺序a→_______→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣.b.加入盐酸调pH;c.加入Ba(OH)2溶液;d.加入Na2CO3溶液;e.过滤
向饱和食盐水中先通入NH3,后通人CO2,理由是_____________________。
(2)灼烧固体A制Na2CO3在_____填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是__________________________________________________________。
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+,K+的溶液中加入少量NH4HCO3。使pH降低,反应的离子方程式____________________________________。
(3)下图装置中常用于实验室制备CO2的是_____(填字母编号);用b示意的装置制备NH3,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂__________(填试剂名称)。

(4)一种天然碱晶体成分是aNa2CO3·bNa2CO3·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实骏方案。(仪器自选)请把实验方案填全:供选择的试剂:1.0mol/LH2SO4溶液、1.0mol/L BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水
①称取m1g一定量天然碱晶体样品,溶于适量蒸馏水中。
②_________________________________________________________________。
③_________________________________________________________________。
④计算天然碱晶体中含Na2CO3的质量分数。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省汕头市高考模拟考试(一)理综化学试卷(解析版) 题型:计算题
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液。②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。写出②中反应的化学方程式__________________________。
(2)如将CO2与H2 以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是 (填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入 2
mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)
△H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
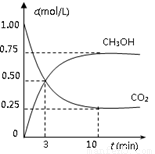
从反应开始到平衡,v(H2)= ;氢气的转化率= ;能使平衡体系中n(CH3OH)增大的措施有__________________________________________________。
(3)如将CO2与H2 以1:4的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) +2O2(g)=CO2(g)+2H2O(l) △H1=―890.3 kJ/mol
H2(g) + 1/2O2(g)=H2O(l) △H2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是____________________。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
|
溶解度(S)/g |
溶度积(Ksp) |
||
|
Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
|
0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是 (填“Ca(OH)2”或“Ba(OH)2”)溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com