
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1 AlC13溶液中:H+、Na+、Cl-、SO![]()
B.含有0.1mol·L-1 Fe3+的溶液中:Na+、K+、SCN-、NO![]()
C.使甲基橙变红色的溶液中:Fe2+、K+、NO![]() 、SO
、SO![]()
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH![]() 、SO
、SO![]() 、HCO
、HCO![]() 、Cl-
、Cl-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图,下列叙述不正确的是( )
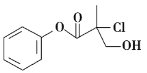
A.有机物A含有3种官能团
B.有机物A和NaOH的醇溶液共热可发生消去反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.有机物A能使溴水和酸性高锰酸钾溶液均褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学对![]() 、
、![]() 、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
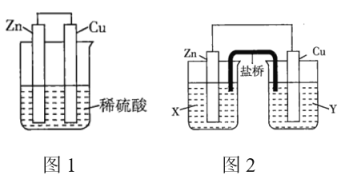
(1)实验表明,图1中铜电极上有气泡产生,说明反应中有一部分化学能转化为_______能。
(2)图2中的X、Y分别是![]() 溶液、稀硫酸,实验过程中只有正极上产生气泡,则X是_______,正极上的电极反应式为_______。
溶液、稀硫酸,实验过程中只有正极上产生气泡,则X是_______,正极上的电极反应式为_______。
(3)当图1装置中的溶液质量增加![]() 时,生成氢气_______L(标准状况);当图2中锌电极的质量减少
时,生成氢气_______L(标准状况);当图2中锌电极的质量减少![]() 时,电路中转移的电子为_______
时,电路中转移的电子为_______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol/L NaOH溶液480 mL和1.0 mol/L硫酸溶液250 mL。根据这两种溶液的配制情况回答下列问题。
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
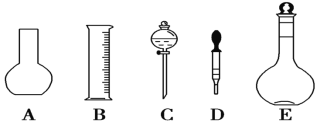
(2)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.3 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.3 mol/L。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为_______mL(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.用惰性电极电解MgCl2溶液:2Cl-+H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B.碳酸钠溶液显碱性:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
C.氯气通入冷水中:Cl2 +H2O ![]() Cl-+ClO-+2H+
Cl-+ClO-+2H+
D.碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH= 2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素,请回答下列问题:
⑴基态Co原子核外电子占据________种不同的能级,其中有________个未成对电子。
⑵Co能形成[Co(CNO)6]3-
①1 mol该离子中含有δ键的数目为________。
②与CNO-互为等电子体的分子为________(填化学式,任写一种)。
③相同压强下,CO晶体的熔点高于N2晶体的原因是________。
⑶氟硼酸铵(NH4BF4)用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等.是合成氮化硼纳米管的原料之一。
①1 mol NH4BF4含有_______ mol配位键。
②第一电离能大小介于B和N之间的基态原子第一电离能由大到小的顺序为________(用元素符号表示)。
③BF4-的空间立体构型为________,其中硼原子的杂化轨道类型为________。
④BN晶体有多种结构,其中六方相氮化硼![]() 如图甲
如图甲![]() 是通常存在的稳定相,其结构与石墨相似却不导电,原因是_______,而立方氮化硼具有金刚石型结构,其晶胞如图乙所示,若晶胞参数为a pm,晶胞密度为d gcm-3,则阿伏加德罗常数的值可表示为________mol-1。
是通常存在的稳定相,其结构与石墨相似却不导电,原因是_______,而立方氮化硼具有金刚石型结构,其晶胞如图乙所示,若晶胞参数为a pm,晶胞密度为d gcm-3,则阿伏加德罗常数的值可表示为________mol-1。
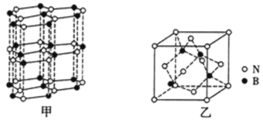
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据![]() 科技日报
科技日报![]() 报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
请回答下列问题:
⑴在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该原子的外围电子排布式为____________。
⑵在第四周期过渡金属中,基态原子第一电离能最大的元素是___________(填元素符号)。
⑶铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为________________。
⑷常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①CH3OH、HCHO、 HCOOH的沸点分别为64.7℃、-195℃、100.8℃,其主要原因是____________________;
②CH4和HCHO比较,键角较大的是_________,该分子的空间构型为____________。
⑸配离子中受配体的影响,中心离子同能级d轨道的能量不同,人们把1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量称为d的分裂能,用符号![]() 表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+________Δ[Co(H2O)6]3+(填“>”“<”或“=”
表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+________Δ[Co(H2O)6]3+(填“>”“<”或“=”![]() ,理由是____________。
,理由是____________。
⑹钴晶胞和白铜(铜镍合金)晶胞如图所示。
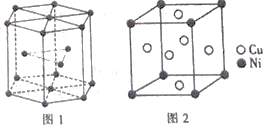
①钴晶胞堆积方式的名称为____________;
②已知白铜晶胞的密度为dgcm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为____________pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次递增的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为__________。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为__________。
(3)C、D、E元素的第一电离能由大到小的顺序是__________。(用元素符号表示)
(4)A和D形成的18电子化合物难溶于BE2,其理由是__________,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为__________
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是__________。
(6)F与C形成化合物的晶胞如图所示,该化合物的化学式为_____________,C离子的配位数是_____________。
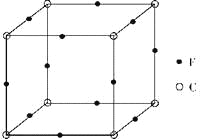
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com