


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高一化学(上) 题型:021
可能存在的第119号未知元素,有人称为“类钫”,根据碱金属元素性质变化规律,有关“类钫”的预测,说法正确的是
[ ]
A.“类钫”在化合物中呈+1价
B.“类钫”元素具有放射性
C.“类钫”单质的密度小于1g·cm-3
D.“类钫”单质有较高的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的电离能对元素的性质影响很大。
(1)观察下表总结三条有关第一电离能变化的规律
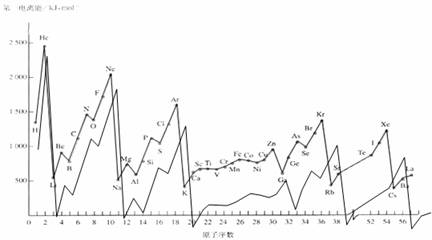
例如:同周期主族元素的第一电离能的变化趋势是由小变大;
;
;
。
(2)
| Li | Na | K | |
| 熔点 | 180 | 98 | 63 |
| 沸点 | 1347 | 881 | 756 |
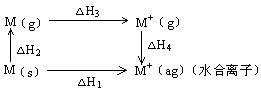
根据以上三个图表回答:(M表示碱金属)
△H2(Li) △H2(Na), △H3(Li) △H3(Na),
已知金属锂比钠活泼,则△H4(Li) △H4(Na)。
(3)钒(V)原子的基态电子排布式为: ,钒元素的最高化合价为 。
(4)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的电离能对元素的性质影响很大。
(1)观察下表总结三条有关第一电离能变化的规律
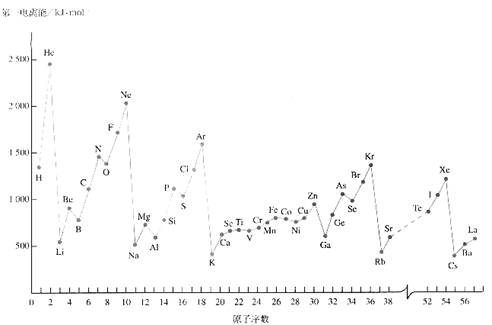
例如:同周期主族元素的第一电离能的变化趋势是由小变大;
;
;
。
(2)
| Li | Na | K | |
| 熔点 | 180 | 98 | 63 |
| 沸点 | 1347 | 881 | 756 |
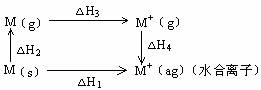
根据以上三个图表回答:(M表示碱金属)
△H2(Li) △H2(Na), △H3(Li) △H3(Na),
已知金属锂比钠活泼,则△H4(Li) △H4(Na)。
(3)钒(V)原子的基态电子排布式为: ,钒元素的最高化合价为 。
(4)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com