
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:分析 (1)已知CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ•mol-1①,
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②,
将方程式2×①+②可得CH4与O2反应生成CO和H2的热化学方程式;
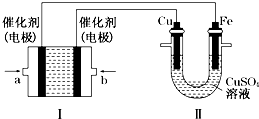
(2)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂;正极发生还原反应,氧气得电子被还原;
②根据I中氢氧根离子浓度变化确定溶液pH变化;II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量;
③I中还有碳酸根离子生成;
④根据转移电子相等计算消失氧气的体积.
解答 解:(1)CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ•mol-1①,
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②,
将方程式2×①+②得 2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1 ,
故答案为:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1 ;
(2)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以a处通入的气体是甲烷;甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为CH4+10OH--8e-=CO32-+7H2O,b处通入氧气,电极上发生的电极反应式是O2+2H2O+4e-═4OH-,
故答案为:CH4;O2+2H2O+4e-═4OH-;
②根据I中电池反应为CH4+2O2+2KOH=K2CO3+3H2O,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;
II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量,则溶液中铜离子浓度不变,
故答案为:变小;不变;
③I中负极反应为CH4+10OH--8e-=CO32-+7H2O,所以还有CO32-离子生成,故答案为:CO32-;
④装置Ⅱ中阴极质量变化12.8g,n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,则转移0.4mol电子,
串联电路中转移电子相等,由O2+2H2O+4e-═4OH-,可知消耗0.1mol氧气,体积为2.24L,
故答案为:2.24.
点评 本题考查了盖斯定律、原电池和电解池原理,根据电解池中Cu、Fe电极上发生的反应确定燃料电池中正负极及电极上通入的气体,再结合转移电子相等计算,难点是电极反应式的书写.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:填空题
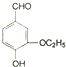 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.
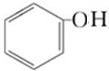 ,B
,B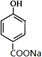 ;
;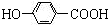 +CH3CH2OH$→_{△}^{离子液体}$
+CH3CH2OH$→_{△}^{离子液体}$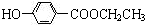 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
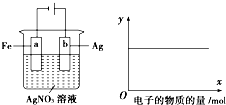 按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )
按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )| A. | ①③ | B. | ③④ | C. | ①②④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2气体通入含有氢氧化钠的酚酞溶液中,溶液褪色 | |
| B. | 将SO2气体通入澄清石灰水中,溶液变浑浊 | |
| C. | 将SO2通入品红溶液中,溶液褪色 | |
| D. | 将SO2气体通入碘水溶液中,溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(O2)=0.01mol/L•s | B. | V(NO)=0.008mol/L•s | ||
| C. | V(H2O)=0.003mol/L•min | D. | V(NH3)=0.002mol/L•s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用 NaHCO3 溶液可一次鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 | |
| B. | 高锰酸钾试剂瓶内壁上黑色物质可用稀盐酸洗涤 | |
| C. | 除去SO2 中少量HCl,将其通入饱和的Na2SO3 溶液 | |
| D. | 将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com